
Ароматические углеводороды (арены)
| Категория реферата: Биология и химия
| Теги реферата: отчет по практике, дипломная работа по психологии
| Добавил(а) на сайт: Дмитрий.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 11 | Следующая страница реферата
![]()
![]()
![]()
![]() СН СН
СН СН
![]()
![]()
![]() СН СН
СН СН
СН
![]()
![]()
![]()
![]()
![]()
![]() Кекуле предположил, что двойные связи в бензоле не
неподвижны; по его представлениям, они непрерывно перемещаются (осцилируют) в
кольце, что можно представить схемой: СН (I)
СН (II)
Кекуле предположил, что двойные связи в бензоле не
неподвижны; по его представлениям, они непрерывно перемещаются (осцилируют) в
кольце, что можно представить схемой: СН (I)
СН (II)
![]() Формулы I и II, согласно Кекуле, СН СН
СН СН
Формулы I и II, согласно Кекуле, СН СН
СН СН
![]() совершено равнозначны и лишь ½ ½ <=> ½ ½
совершено равнозначны и лишь ½ ½ <=> ½ ½
![]()
![]()
![]()
![]()
![]() выражают 2 взаимно переходящие СН
СН СН СН
выражают 2 взаимно переходящие СН
СН СН СН
![]() фазы соединения молекулы бензола. СН СН
фазы соединения молекулы бензола. СН СН
К этому выводу Кекуле пришел на том основании, что если бы положение двойных связей в бензольном было зафиксировано, то его двухзамещенные производные C6H4X2 с заместителями при соседних углеродах должны были бы существовать в виде изомеров по положению простых и двойных связей:
Х Х
½ (III) ½ (IV)
![]()
![]()
![]()
![]()
![]()
![]() С С
С С
НС С—Х НС С—Х
½½ ½ <=> ½ ½½
![]()
![]()
![]()
![]()
![]()
![]() НС СН НС СН
НС СН НС СН
СH СH
В одном (III) атомы углерода, при которых расположены заместители X, были бы соединены двойной связью, в другом (IV) – простой. Однако все попытки получить такие изомеры не увенчались успехом. С точки зрения же представлений об осцилляции связей эти изомеры не могут существовать, т.е. формулы III и IV выражают строение одного и того же вещества, для которого возможны две взаимно переходящие фазы состояния молекулы.
Формула Кекуле получила широкое распространение. Она согласуется с представлениями о четырехвалентности углерода, объясняет равноценность водородных атомов в бензоле. Наличие в последнем шестичленного цикла доказано; в частности, оно подтверждено тем, что при гидрировании бензол образует циклогексан, в свою очередь циклогексан путем дегидрирования превращается в бензол.
Однако формула Кекуле имеет существенные недостатки. Допуская, что в бензоле имеются три двойных связи, она не может объяснить, почему бензол в таком случае с трудом вступает в реакции присоединения, устойчив к действию окислителей, т.е. не проявляет свойств непредельных соединений.
Исследование бензола с применением новейших методов указывает на то, что в его молекуле между углеродными атомами нет ни обычных простых, ни обычных двойных связей. Например, изучение ароматических соединений при помощи лучей Рентгена показало, что 6 атомов углерода в бензоле, образующие цикл, лежат в одной плоскости в вершинах правильного шестиугольника и центры их находятся на равных расстояниях друг от друга, составляющих 1,40 А. Эти расстояния меньше, чем расстояния между центрами углеродных атомов, соединенных простой связью (1,54 А), и больше, чем м. соединенными двойной связью (1,34 А). Таким образом, в бензоле углеродные атомы соединены при помощи особых, равноценных между собой связей, которые были названы ароматическими связями. По природе своей они отличаются от двойных и простых связей; наличие их и обуславливает характерные свойства бензола. С точки зрения современных электронных представлений природу ароматических связей объясняют следующим образом.
Как уже было указано ранее, простая связь между атомами углерода осуществляется одной парой, а двойная – двумя парами обобщенных электронов. Одна из электронных пар двойной связи находится в таком же состоянии, как пара электронов, осуществляющая простую связь (s-связь). Вторая же электронная пара осуществляет связь особого характера (π-связь). В соответствии с формулой Кекуле в бензоле должны быть три π-связи. На самом же деле в бензоле нет обычных пар π-электронов фиксированных между двумя определенными С-атомами, как это изображает схема I. В шестичленном цикле бензола все простые связи С-С и С-Н (s-связи) лежат в одной плоскости. Облака π-электронов всех С-атомов, имеющие форму объемных восьмерок, направлены перпендикулярно плоскости бензольного кольца. Каждое из таких облаков перекрывается облаками двух соседних углеродных атомов. Это показано на следующем рисунке:
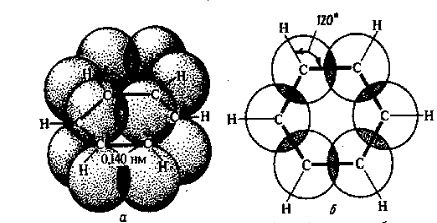 |
Рис. 9. Взаимное перекрывание 2р-орбиталей в молекуле бензола:
а – вид сбоку, б – вид сверху.
Плотность облаков π-электронов в бензоле равномерно распределена между всеми С-С-связями. Следовательно, π-электроны обобщены всеми углеродными атомами кольца, образуя единое кольцевое облако шести электронов (ароматический электронный секстет). Таким образом объясняется равноценность (выравненность) ароматических связей, придающих бензольному ядру характерные (ароматические) свойства. Равномерное распределение облака π-электронов и выравненность связей в бензоле иногда изображают формулой (4). И в настоящее время бензол продолжают изображать формулой Кекуле (1). Но всегда надо помнить, что она неверно отражает характер связей в бензоле.
Рекомендуем скачать другие рефераты по теме: клетка реферат, договора диплом.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 11 | Следующая страница реферата
 Главная
Главная