
Бинарные жидкие системы
| Категория реферата: Биология и химия
| Теги реферата: пожарные рефераты, древний египет реферат
| Добавил(а) на сайт: Rjawin.
Предыдущая страница реферата | 1 2 3 4 5 6 7 | Следующая страница реферата
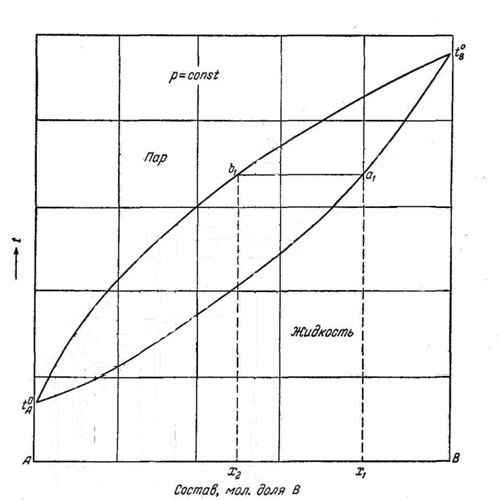
Рис. 8.4. Диаграмма состав-температура кипения двойных смесей.
Реальное
давление насыщенного пара индивидуальной жидкости при данной температуре есть
характерная величина. Практически нет жидкостей, которые бы обладали
одинаковыми значениями давления насыщенного пара при одной и той же
температуре. Поэтому ![]() всегда больше или меньше
всегда больше или меньше ![]() . Если
. Если ![]() >
>![]() , то
, то ![]() >
>![]() , т.е. состав
паровой фазы обогащен компонентом А. Изучая растворы, Д.П. Коновалов (1881г.)
сделал обобщение, получившее название первого закона Коновалова.
, т.е. состав
паровой фазы обогащен компонентом А. Изучая растворы, Д.П. Коновалов (1881г.)
сделал обобщение, получившее название первого закона Коновалова.
В двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении.
Первый закон Коновалова является теоретической основой для разделения жидких растворов на исходные компоненты путем фракционной перегонки. Например, система, характеризуемая точкой К, состоит из двух равновесных фаз, состав которых определяется точками a и b: точка а характеризует состав насыщенного пара, точка b - состав раствора.
По графику можно провести сопоставления составов паровых и жидких фаз для любой точки, заключенной в плоскости между кривыми.
Реальные растворы. Закон Рауля не выполняется для реальных растворов. Отклонение от закона Рауля существует двух типов:
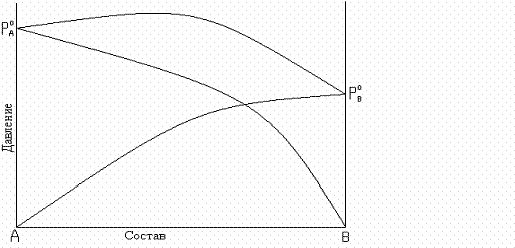
парциальное давление растворов больше давлений или летучести паров идеальных растворов. Общее давление пара больше аддитивной величины. Такие отклонения называются положительными, например, для смесей (рис. 8.5 а, б) CH3COCH3-C2H5OH, CH3COCH3-CS2, C6H6- CH3COCH3, H2O-CH3OH, C2H5OH-CH3OCH3, CCl4-C6H6 и др.;
а
 б
б
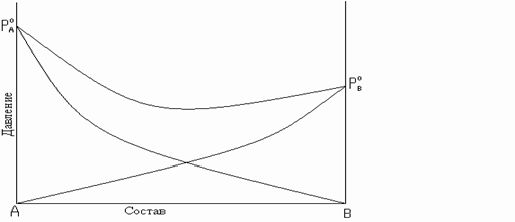
Рис. 8.5. Зависимость общего и парциальных давлений пара от состава:
а – для смесей с положительным отклонением от закона Рауля;
б – для смесей с отрицательным отклонением от закона Рауля.
парциальное давление растворов меньше давлений паров идеальных растворов. Общее давление пара меньше аддитивной величины. Такие отклонения называются отрицательными. Например, для смеси: H2O-HNO3; H2O-HCl; CHCl3-(CH3)2CO; CHCl3-C6H6 и т.д.
Положительные отклонения наблюдаются в растворах, у которых разнородные молекулы взаимодействуют с меньшей силой, чем однородные.
Это облегчает переход молекул из раствора в паровую фазу. Растворы с положительным отклонением образуются с поглощением теплоты, т.е. теплота смешения чистых компонентов будет положительной, происходит увеличение объема, уменьшение ассоциации.
Отрицательные отклонения от закона Рауля возникают в растворах, у которых происходит усиление взаимодействия разнородных молекул, сольватация, образование водородных связей, образование химических соединений. Это затрудняет переход молекул из раствора в газовую фазу.
Сущность разделения (разгонки) бинарных жидких растворов
Как можно разделить бинарную смесь на составляющие компоненты? Предложим, что смесь состоит из воды и ацетона в соотношении 1:1.
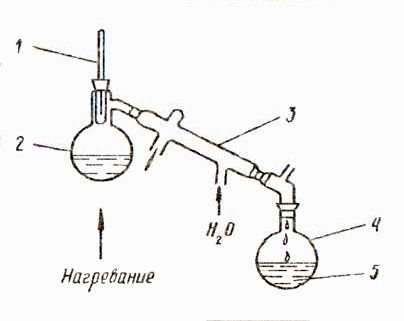
Для разделения смеси необходимо (рис. 8.6):
1. нагреть смесь до кипения с целью увеличения скорости испарения жидкости.
2. образовавшуюся паровую фазу сконденсировать.
Как меняется состав разделяющейся смеси и как изменяется состав конденсата в ходе кипячения?
 |
Рекомендуем скачать другие рефераты по теме: реферат на тему образ жизни, ответы по биологии.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 7 | Следующая страница реферата
 Главная
Главная