
Что и как закодировано в мРНК
| Категория реферата: Биология и химия
| Теги реферата: реферат научный, реферат на тему право
| Добавил(а) на сайт: Bojarinov.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
Рис. 3. Некоторые примеры отступления от общих правил трансляции генетической информации: узнавание инициирующего кодона на мРНК бактерий (а); прочитывание терминирующего кодона UGA как кодона аминокислоты селеноцистеина (б ); сдвиг рамки считывания на -1 при трансляции ретровирусной РНК (в); сдвиг рамки считывания на +1 при трансляции мРНК бактериального фактора терминации трансляции RF-2 (г); прыжок рибосомы на 50 нуклеотидов при трансляции мРНК гена 60 бактериофага Т4 (д). Рекодирующие сигналы на мРНК обозначены красным цветом. Дальнейшие пояснения см. в тексте
Если первый AUG в эукариотической мРНК находится не в оптимальном контексте, он пропускается и инициация начинается со следующего AUG. Для такой инициации очень важно также наличие кэп-структуры на 5'-конце мРНК и, как ни странно, поли(А) последовательности на противоположном конце молекулы. Кэп-структура и поли(А) последовательность узнаются специфическими белками, которые также необходимы для инициации. При таком способе инициации трансляции у эукариот последовательность мРНК как бы просматривается (сканируется) с начала мРНК (от ее кэп-структуры) для поиска кодона AUG в оптимальном контексте. Такая инициация получила название "кэп-зависимая инициация по сканирующему механизму". Следует, однако, заметить, что на некоторых мРНК эукариот инициация происходит не путем сканирования мРНК с 5'-конца, а за счет непосредственного узнавания определенного внутреннего AUG. Для такого узнавания требуется весьма протяженная предшествующая последовательность мРНК. Эта последовательность узнается особыми клеточными белками, которые способствуют инициации трансляции по механизму "внутренней инициации". По такому механизму инициируется трансляция на многих вирусных РНК, а также на некоторых клеточных мРНК, кодирующих очень важные регуляторные белки, например факторы роста фибробластов. Содержание этих белков обычно очень мало, а увеличение их количества в клетке может сопровождаться трансформацией клеток в раковые. Некоторые вирусы, генетическая информация которых считывается по механизму внутренней инициации трансляции, способны выключить инициацию трансляции клеточных мРНК по сканирующему механизму и, таким образом, переключать белоксинтезирующий аппарат клетки на синтез собственных белков.
Контекст может изменить значение кодона внутри цистрона. Долгое время полагали, что непосредственно в белок включаются только двадцать стандартных аминокислот, приведенных в таблице генетического кода (см. рис. 2). Другие многочисленные минорные аминокислотные остатки, обнаруживаемые в белках, появляются в них уже после синтеза белка в результате так называемых посттрансляционных модификаций некоторых из двадцати стандартных аминокислот. Сравнительно недавно, однако, было показано, что аминокислота селеноцистеин (очень редкая, но функционально очень важная аминокислота) непосредственно включается в белок. Возникает закономерный вопрос, как же закодирована эта аминокислота. Ведь значение всех 64 возможных кодонов уже четко определено, и все они используются в кодировании двадцати стандартных аминокислот и сигналов терминации.
Исследования показали, что селеноцистеин кодируется UGA (терминирующим кодоном в таблице генетического кода), если за ним находится особая стимулирующая последовательность. Эта последовательность может отстоять от UGA на очень большом расстоянии - иногда она может быть на расстоянии 200 нуклеотидов и находиться в 3'-нетранслируемой области мРНК (рис. 3, б ).
Некоторые мРНК содержат сигналы на изменение рамки считывания. Некоторые мРНК содержат в транслируемой области терминирующие кодоны, но эти кодоны успешно обходятся за счет изменения рамки считывания перед ними или непосредственно на них. Рамка может сдвигаться на -1, +1 и + 2. Существуют специальные сигналы в мРНК, изменяющие рамку считывания. Так, сдвиг рамки трансляции на -1 на РНК ретровируса происходит на специфической гептануклеотидной последовательности перед шпилечной структурой в мРНК (рис. 3, в). Для сдвига рамки на +1 на мРНК бактериального фактора терминацинации RF-2 важны нуклеотидная последовательность на месте сдвига (кодон UGA), последующий кодон, а также предшествующая им последовательность, комплементарная к 3'-концевой последовательности рибосомной РНК (аналог последовательности Шайна-Дальгарно) (рис. 3, г).
Считывание мРНК в пределах одного цистрона не всегда является непрерывным. Первоначально считалось, что последовательность нуклеотидов в мРНК всегда читается непрерывно от инициирующего до терминирующего кодона. Однако оказалось, что при трансляции мРНК гена 60 фага Т4 последовательность значительной длины может пропускаться (рис. 3, д). При этом рибосома совершает как бы прыжок по мРНК с одного глицинового кодона GGA, находящегося перед терминирующим кодоном UAG, на другой глициновый кодон GGA, который отстоит от первого на 50 нуклеотидов. Механизм этого явления пока не очень ясен. Не исключено, что такое шунтирование мРНК обеспечивается ее особой пространственной структурой, например выпетливанием той части молекулы мРНК, которая пропускается при трансляции.
Все приведенные примеры нарушения общих правил кодирования так или иначе связаны с существованием определенного контекста в мРНК. Этот контекст или перекодирующие сигналы иногда называют вторым генетическим кодом.
МНОГИЕ мРНК СОДЕРЖАТ СИГНАЛЫ ПОЛИАДЕНИЛИРОВАНИЯ
Около половины мРНК эукариот полиаденилируются на 3'-конце во время процессинга в клеточном ядре. Сигналом ядерного полиаденилирования 3'-конца служит последовательность AAUAAA, расположенная за 10-20 нуклеотидов от этого конца. В некоторых случаях, например в зрелых ооцитах амфибий или сухих, неактивных в белковом синтезе зародышах пшеницы, мРНК не полиаденилированы. Активация белкового синтеза в развитии сопровождается полиаденилированием этих мРНК в цитоплазме. Для цитоплазматического полиаденилирования мРНК должны содержать в 3'-нетранслируемой области наряду с элементом ядерного полиаденилирования дополнительную последовательность - элемент цитоплазматического полиаденилирования. Такой последовательностью у амфибий является (U)6AUAAAG. Поли(А)-хвост на мРНК узнается особым поли(А)-связывающим белком, который участвует в инициации трансляции мРНК по кэп-зависимому механизму.
СПЕЦИФИЧЕСКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ В мРНК ОТВЕЧАЮТ ЗА РЕГУЛЯЦИЮ ЕЕ МАТРИЧНОЙ АКТИВНОСТИ В БЕЛКОВОМ СИНТЕЗЕ
Матричная активность различных мРНК сильно различается. Очень активными (сильными) матрицами являются фаговые и вирусные РНК, а также клеточные мРНК для мажорных белков клетки, таких, например, как глобины. Наоборот, матрицы для белков, присутствующих в клетке в малых количествах, как правило, являются очень слабыми. Сила матрицы чаще всего определяется эффективностью процесса ее инициации. У эукариот помимо контекста нуклеотидов в районе инициирующего триплета (см. выше) эффективность матрицы сильно падает при наличии в 5'-нетранслируемой области развитой вторичной структуры (образовании двуспиральных участков, таких, как шпильки), а также, по-видимому, с увеличением длины 5'-НТО выше определенного предела. Активность эукариотических мРНК в трансляции катастрофически уменьшается при их декэпировании или введении в 5'-НТО кодонов AUG, в контексте, неоптимальном для инициации. Прокариотические мРНК плохо транслируются, если инициирующие кодоны находятся в двойных спиралях.
Избирательное влияние на активность мРНК в трансляции оказывают специфические регуляторные белки или специальные регуляторные РНК. Эти белки или РНК проявляют свое действие, связываясь со специфическими последовательностями или структурами в мРНК, которые называются регуляторными элементами. В большинстве случаев регуляторные элементы располагаются в 5'-НТО вблизи инициирующего кодона. Однако в некоторых случаях регулярные элементы могут быть на значительном расстоянии от инициирующего кодона, в том числе в 3'-НТО. Связываясь с мРНК вблизи инициирующего кодона, регуляторные белки могут создавать препятствия для компонентов белоксинтезирующего аппарата (мешать связыванию с мРНК или ее сканированию). При связывании с мРНК на большом расстоянии от места инициации регуляторные белки могут влиять на процесс инициации путем изменения общей пространственной структуры мРНК, изменяя таким образом доступность инициирующего кодона или 5'-конца мРНК для белоксинтезирующего аппарата.
Регуляторными белками могут быть специальные белки клетки, выполняющие только эту функцию в организме, а также белки, имеющие в организме другие функции и работающие в качестве регуляторных белков "по совместительству". Довольно часто в качестве белков, регулирующих активность определенных мРНК, могут выступать сами продукты их трансляции (авторегуляция). Обратимся теперь к некоторым конкретным примерам.
Трансляция мРНК треонил-тРНК-синтетазы у бактерий находится под контролем ее продукта (авторегуляция). Авторегуляция достигается за счет специфического сродства треонил-тРНК-синтетазы к своей матрице. Связывание синтетазы с мРНК происходит в ее 5'-НТО со специфической последовательностью (регуляторным элементом), которая складывается во вторичную структуру, напоминающую отдельные элементы вторичной структуры треониловой тРНК. При ограниченном количестве фермента в клетке он ассоциирует главным образом со своим субстратом - треонил-тРНК. В этих условиях мРНК треонил-тРНК-синтетазы может активно транслироваться. При увеличении количества этого фермента избыточный фермент взаимодействует с регуляторным элементом в 5'-НТО своей мРНК. Это приводит к переходу мРНК в такую конформацию, в которой инициирующий триплет оказывается вовлеченным в двуспиральную структуру. В результате инициация синтеза треонил-тРНК-синтетазы прекращается.
Яркий пример регуляции трансляции мРНК в эукариотических клетках получен при изучении механизмов поддержания в клетках уровня свободного железа. Железо входит в состав активных центров очень многих белков, таких, например, как гемоглобин , миоглобин, цитохромы , однако ионы свободного железа токсичны для клетки и поэтому связываются и переводятся в нетоксичную форму белком ферритином. Синтез ферритина в клетке, в свою очередь, зависит от уровня свободного железа: в присутствии железа ферритин синтезируется, в то время как при его недостатке трансляция мРНК ферритина останавливается на стадии инициации. Выяснилось, что регуляция синтеза ферритина целиком зависит от специфической последовательности длиной 26 нуклеотидов, образующей шпилечную структуру в 5'-НТО мРНК ферритина (рис. 4, а). Этот регуляторный элемент при отсутствии железа связывается со специфическим белком, который препятствует сканированию 5'-НТО рибосомами и, таким образом, подавляет трансляцию мРНК на стадии ее инициации. Этот белок- репрессор имеет сродство к ионам железа и при связывании с ними перестает связываться с ферритиновой мРНК. После диссоциации белка мРНК становится активной в синтезе ферритина.
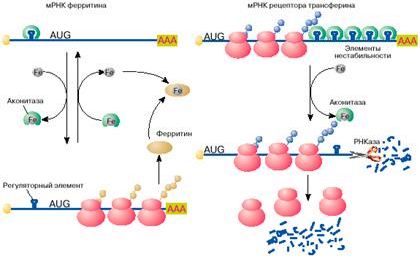
Рис. 4. Регуляция железом трансляции мРНК ферритина и стабильности мРНК рецептора трансферина
Вновь синтезированный ферритин отнимает железо у репрессора. Утратив железо, репрессор опять приобретает сродство к регуляторному элементу ферритиновой мРНК, связывается с ним и останавливает синтез ферритина. Большим сюрпризом явилось то, что белок-репрессор оказался хорошо известным ферментом цикла Кребса - аконитазой.
ОСОБЫЕ СТРУКТУРНЫЕ ЭЛЕМЕНТЫ мРНК ОПРЕДЕЛЯЮТ ВРЕМЯ ЖИЗНИ мРНК В КЛЕТКЕ
Скорость синтеза белка зависит от количества соответствующей мРНК в клетке. Содержание мРНК, в свою очередь, определяется скоростью ее синтеза и распада. Механизмы регуляции транскрипции мРНК начали исследовать еще в начале 60-х годов, механизмы регуляции процесса ее деградации - значительно позже, всего 5-10 лет назад.
Время жизни разных мРНК в клетках эукариот варьирует в очень широких пределах. Период их полураспада составляет от десятков минут до десятка суток. Наиболее стабильными являются мРНК, на которых синтезируются белки, обеспечивающие функционирование организма как целого (например, мРНК сывороточного альбумина ). Некоторые мРНК распадаются на определенных стадиях клеточного цикла или определенных этапах процесса клеточной дифференцировки. Время жизни мРНК в клетке, равно как и момент их деградации, запрограммировано специфическими последовательностями или структурами в мРНК, часто в их 3'-нетранслируемой области. Эти последовательности (структуры) обычно узнаются специфическими белками. Их связывание с соответствующими белками обычно приводит к стабилизации мРНК.
Например, за деградацию гистоновых мРНК на определенной стадии клеточного цикла отвечает особая шпилечная структура в 3'-НТО - элемент нестабильности мРНК. Введение такой структуры в 3'-НТО очень стабильной глобиновой мРНК приводит к ее деградации одновременно с гистоновыми мРНК. Для того чтобы эта структура выполняла свою функцию элемента нестабильности, она должна находиться на определенном, достаточно близком расстоянии от терминирующего кодона. Дестабилизирующим действием в мРНК онкобелка c- myc обладает AU-богатая последовательность длиной 60-80 нуклеотидов в 3'-НТО этой мРНК. В этой последовательности был выявлен многократно повторяющийся мотив AUUUA, который и является элементом нестабильности. Сходная последовательность была обнаружена в 3'-НТО мРНК для другого онкобелка - c-fos. Однако в этой мРНК имеется еще один элемент нестабильности, который находится в транслируемой области.
Содержание свободного железа в клетке зависит не только от количества в клетке белка ферритина, но и от скорости его поступления в клетку. Скорость поступления железа в клетку возрастает с увеличением на поверхности клетки количества рецепторов для белка трансферина. Последний выполняет функцию переносчика железа. Оказалось, что синтез рецептора трансферина, так же как и ферритина, регулируется железом, но совсем по другому механизму. В присутствии железа в клетке мРНК рецептора трансферина быстро деградирует и синтез этого белка замедляется, в то время как при дефиците железа внутри клетки эта мРНК стабилизируется, обеспечивая высокий уровень синтеза белка. Нестабильность мРНК рецептора трансферина в присутствии железа определяется пятью шпилечными структурами в 3'-НТО (рис. 4, б ). Эти шпилечные структуры (элементы нестабильности мРНК рецептора трансферина) очень похожи на регуляторный элемент в 5'-НТО мРНК ферритина. Элементы нестабильности мРНК рецептора трансферина, так же как регуляторный элемент мРНК ферритина, связывают аконитазу в форме, не содержащей железа. В комплексе с аконитазой мРНК стабилизируется и активно транслируется. В результате на поверхности клеток увеличивается количество рецепторов трансферина и повышается поступление железа в клетки. При увеличении содержания свободного железа в клетках оно связывается с аконитазой. Аконитаза диссоциирует из комплекса с мРНК. Молекула мРНК дестабилизируется и быстро распадается. Это ведет к снижению скорости синтеза рецептора трансферина, уменьшению количества рецепторов на поверхности клетки и замедлению поступления железа в клетку.
Таким образом, один и тот же клеточный белок - аконитаза выполняет в клетке различные функции: в железосодержащей форме катализирует одну из реакций цикла Кребса - обратимое превращение лимонной кислоты в изолимонную, в форме без железа связывается с регуляторным элементом в 5'-НТО мРНК ферритина и репрессирует ее трансляцию, а также с элементами нестабильности в 3'-НТО мРНК рецептора трансферина и защищает эту мРНК от деградации.
СПЕЦИФИЧЕСКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ В мРНК ОТВЕЧАЮТ ЗА ЕЕ ВНУТРИКЛЕТОЧНУЮ ЛОКАЛИЗАЦИЮ
Рекомендуем скачать другие рефераты по теме: реферат суды, безопасность доклад.
Категории:
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
 Главная
Главная