
Электродные потенциалы. Электродвижущие силы
| Категория реферата: Биология и химия
| Теги реферата: чс реферат, реферат по химии
| Добавил(а) на сайт: Agita.
1 2 3 4 | Следующая страница реферата
Электродные потенциалы. Электродвижущие силы
Для определения направления и полноты протекания окислительно-восстановительных реакций между окислительно-восстановительными системами в водных растворах используются значения электродных потенциалов этих систем.
Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией.
К электрохимическим относятся явления, возникающие на границе двух фаз с участием заряженных частиц (ионов и электронов), например, при погружении металлической пластинки в воду.
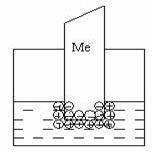
Для всех металлов характерно свойство в большей или меньшей степени растворяться в воде. При этом в воду переходят положительно заряженные ионы металла, в результате чего пластинка (из-за появления в ней избыточных электронов) заряжается отрицательно. Гидратированные катионы металла скапливаются возле поверхности пластинки на границе раздела двух фаз (металл-раствор). Возникает двойной электрический слой, характеризующийся некоторой разностью электростатических потенциалов. Как известно, энергию, которую необходимо затратить (положительный потенциал) или которую можно получить (отрицательный потенциал) при переносе единицы электричества из бесконечности в данную точку, называют электрическим потенциалом. Между пластинкой и раствором устанавливается окислительно-восстановительное равновесие:
 . (9.1)
. (9.1)
При погружении металла в раствор его соли также возникает двойной
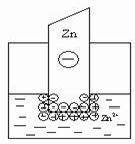
электрический слой, но в этом случае возможны два механизма его образования. Если концентрация катионов металла в растворе мала или металл довольно активный, вследствие чего равновесие процесса, указанного выше, сдвинуто вправо, то металлическая пластинка заряжается отрицательно:
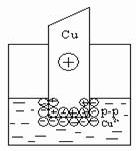
В том случае, когда концентрация катионов металла в растворе велика или металл малоактивный, равновесие указанного процесса сдвигается влево и металлическая пластинка заряжается положительно:
В любом случае на границе раздела двух фаз образуется двойной электрический слой. Разность (скачок) потенциалов, возникающая между металлом и жидкой фазой, называется электродным потенциалом Е. Потенциалу металла приписывается тот знак, который возникает на его поверхности в двойном электрическом слое.
Пластинка металла и раствор его соли (т.е. катионы этого металла) вместе составляют единую окислительно-восстановительную систему, характеризующуюся определенным электродным потенциалом, который зависит от природы металла, концентрации его ионов в растворе, от температуры и рН среды.
При определении скачка потенциала в окислительно-восстановительных системах, не содержащих твердой фазы (например, MnO4-/Mn2+ или Cr2O72-/Cr3+), используют инертные электроды (благородные металлы, графит). В этом случае инертные электроды, адсорбируя из раствора молекулы, атомы или ионы, играют роль твердой фазы, обеспечивающей возникновение скачка потенциалов на межфазной границе.
Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом исследуемой системы и потенциалом электрода сравнения. В качестве стандартного электрода сравнения обычно используют водородный электрод. Он изготавливается из губчатой платины, погруженной в раствор H2SO4 c активностью ионов водорода, равной единице (что соответствует примерно их концентрации, равной 1 моль/л). Через раствор при 298 К (25 оС) под давлением в 101,325 кПа пропускается газообразный водород, который поглощается губчатой платиновой пластиной.
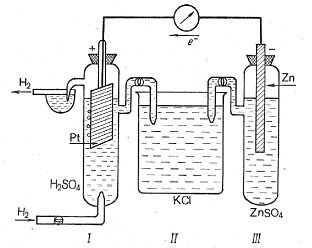
Рис.9.1 Гальваническая цепь для измерения электродного потенциала:
I – водородный электрод, II – солевой мостик, III – измеряемый электрод.
Таким образом, поверхность платинового электрода фактически насыщена водородом, в результате чего в системе устанавливается равновесие:
![]() , (9.2)
, (9.2)
которое
характеризуется определенным значением скачка потенциала на межфазной границе.
Электродный потенциал, отвечающий данным условиям, получил название
стандартного водородного потенциала ![]() , а его
численное значение условно принято равным нулю. Потенциал водородного электрода
воспроизводится с очень высокой точностью.
, а его
численное значение условно принято равным нулю. Потенциал водородного электрода
воспроизводится с очень высокой точностью.
Сочетая электрод, представляющий исследуемую окислительно-восстановительную систему, со стандартным водородным электродом, определяют электродный потенциал Е данной системы. Для того, чтобы можно было сравнивать окислительно-восстановительные свойства различных систем по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов, равная 1 моль/л, давление газообразных веществ 101,325 кПа и температура 298,15 К. Потенциалы, измеренные в таких условиях, носят название стандартных электродных потенциалов и обозначаются Ео. Они часто называются также окислительно-восстановительными или редокс-потенциалами, представляя собой разность между редокс-потенциалом системы при стандартных условиях и потенциалом стандартного водородного электрода.
Знак конкретного Ео соответствует заряду электрода по отношению к стандартному водородному электроду.
Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице.
Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма):
Ox
+ n×![]() = Red. (9.3)
= Red. (9.3)
Эти системы в таблицах расположены в порядке возрастания величин их потенциалов, что соответствует падению восстановительной и росту окислительной активности. Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом.
Рекомендуем скачать другие рефераты по теме: 6 решебник виленкин, культурология.
Категории:
1 2 3 4 | Следующая страница реферата
 Главная
Главная