
Электролиз
| Категория реферата: Биология и химия
| Теги реферата: сочинение базаров, реферат по русскому языку
| Добавил(а) на сайт: Манин.
1 2 3 4 | Следующая страница реферата
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита.
При электролизе энергия электрического тока превращается в химическую энергию, иначе говоря, осуществляется процесс, обратный по характеру происходящему в гальваническом элементе. Как и в случае гальванического элемента, на аноде происходит окисление, а на катоде – восстановление. Но при электролизе анодом является положительный электрод, а катодом – отрицательный.
Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, плотность тока и т.д.).
Различают электролиз расплавов и растворов электролитов.
Электролиз расплавов электролитов.
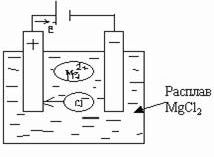
Электролиз расплава соли с использованием инертных электродов показан на следующей схеме:
Анод![]()
При высоких температурах расплав соли диссоциирует на ионы:
![]() .
.
Прохождение электрического тока через расплав обусловлено тремя одновременно протекающими процессами:
направленное движение катионов Мg2+ к катоду, а анионов Cl- - к аноду;
восстановление, происходящее на катоде:
![]()
окисление, происходящее на аноде:
![]()
Суммарное уравнение электролиза после уравнивания числа отдаваемых и присоединенных электронов принимает вид:
![]()
Схематически весь процесс можно представить следующим образом:
![]()
![]()
![]()
![]()
![]() Катод (-) Анод ( + )
Катод (-) Анод ( + )
Mg2+ 2Cl-
![]() Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2
Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2
![]()
Электролиз растворов электролитов
Рекомендуем скачать другие рефераты по теме: решебник 6 класс виленкин, бесплатные контрольные.
Категории:
1 2 3 4 | Следующая страница реферата
 Главная
Главная