
Химическая кинетика и равновесие в гомогенных системах
| Категория реферата: Биология и химия
| Теги реферата: доклады о животны, реферати
| Добавил(а) на сайт: Колвецкий.
1 2 3 4 5 6 7 8 | Следующая страница реферата
Химическая кинетика и равновесие в гомогенных системах
Химической кинетикой называется учение о скорости химических реакций и ее зависимости от различных факторов (концентрации реагентов, t, Р, катализатора и т.д.).
Химические реакции протекают с различной скоростью. Одни реакции заканчиваются в течение долей секунды (разложение взрывчатых веществ), другие – продолжаются минутами, часами, сутками, третьи – длятся десятки, сотни, тысячи лет (процессы, протекающие в земной коре).
Скорость конкретной реакции тоже может изменяться в широких пределах в зависимости от условий ее протекания (смесь водорода и кислорода при обычной температуре может сохраняться без изменений неограниченное время; при введении в нее соответствующего катализатора она реагирует весьма бурно; при 630 °С она реагирует и без катализатора).
Фазой называется часть системы, отличающаяся по своим физическим и химическим свойствам от других частей системы и отделенная от них поверхностью раздела, при переходе через которую свойства системы резко меняются.
Системы, состоящие из одной фазы, называются гомогенными, из нескольких фаз – гетерогенными. Соответственно реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными, а реакции, в которых вещества соединяются в различных фазах – гетерогенными.
Скорость гомогенной химической реакции принято выражать изменением концентрации реагирующих веществ или образовывающихся продуктов реакции в единицу времени. Концентрации исходных веществ в ходе реакции уменьшаются, а концентрации продуктов реакции возрастают во времени. Скорость гомогенной химической реакции по мере израсходования исходных веществ уменьшается.
Средняя скорость реакции vср в интервале времени от t1 до t2 определяется соотношением:
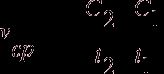 ;
; 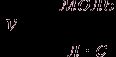 .
.
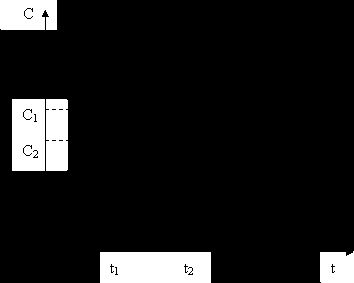
Рис. 5.1. Изменение концентрации исходных веществ во времени.
Мгновенная скорость – это скорость реакции в данный момент времени t. Она определяется производной от концентрации по времени:


Рис. 5.2. Изменение концентрации реагирующих веществ во времени.
Скорость реакции всегда считается положительной. Если при расчетах берем изменение концентрации исходных веществ, то в указанном выражении ставится знак «-»; если это касается продуктов реакции, то следует принимать знак «+».
Факторы, влияющие на скорость химической реакции:
природа реагирующих веществ;
концентрация реагентов;
температура;
катализаторы;
дисперсность (для твердых веществ);
кислотность среды (для реакции в растворах);
форма реактора (для цепных реакций);
интенсивность освещения видимыми или УФ-лучами (для фотохимических реакций);
интенсивность
облучения ![]() -лучами (для
радиационно – химических реакций) и т.д.
-лучами (для
радиационно – химических реакций) и т.д.
Рекомендуем скачать другие рефераты по теме: доклад на тему физика, реферат на тему жизнь.
Категории:
1 2 3 4 5 6 7 8 | Следующая страница реферата
 Главная
Главная