
Химия инертных газов
| Категория реферата: Биология и химия
| Теги реферата: чс реферат, реферат по химии
| Добавил(а) на сайт: Остапюк.
1 2 3 | Следующая страница реферата
Химия инертных газов
Доктор химических наук В. И. Фельдман
Словосочетание „химия инертных газов“ звучит парадоксально. В самом деле, какая химия может быть у инертного вещества, если в его атомах заполнены все электронные оболочки и, стало быть, оно по определению ни с чем не должно взаимодействовать? Однако во второй половине XX века химикам удалось преодолеть оборону заполненных оболочек и синтезировать неорганические соединения инертных газов. А в XXI веке учёные из России и Финляндии получили вещества, которые состоят только из атомов инертного газа, углерода и водорода.
Всё начиналось со фторидов
Собственно говоря, о том, что химические соединения криптона, ксенона и радона с сильными окислителями вполне могут существовать, Лайнус Полинг упоминал ещё в 1933 году. Однако прошло около тридцати лет, прежде чем в 1962 году Нил Бартлетт синтезировал в Канаде первое из таких соединений — XePtF 6, при этом в реакции участвовали благородный газ и мощный окислитель, гексафторид платины. Соображения, на которые учёный опирался в своём поиске, были весьма простыми и интуитивно понятными каждому химику: если гексафторид платины столь силён, что отбирает электрон даже у молекулярного кислорода, то почему он не может это сделать с ксеноном? Ведь внешний электрон у атома этого газа привязан к ядру ничуть не сильнее, чем у кислорода, — об этом свидетельствуют почти одинаковые значения потенциала ионизации. После того как успешный синтез подтвердил гипотезу, было получено целое семейство соединений ксенона с сильными окислителями — фторидов, оксифторидов, оксидов, солей ксеноновой кислоты и многочисленные комплексы. Химики синтезировали также хлорид ксенона и фторсодержащие соединения со связями Xe–B и Xe–N.
В последующие двадцать лет интригующие события развернулись на стыке химии ксенона и органической химии. В семидесятые годы появилось сообщение о синтезе нестабильной молекулы FXeCF 3, а затем и Xe(CF 3 ) 2. В конце восьмидесятых получили уже стабильные ионные соли, в которых катион содержал связь Xe–C (в качестве аниона, как правило, выступал борфторид). Среди соединений такого типа особый интерес (почему — станет понятно позже) представляет соль алкинилксенония — [t–BuC¤CXe] + [BF 4] –, которую синтезировали В.В. Жданкин, П. Стэнг и Н.С. Зефиров в 1992 году. Вообще-то, подобные соединения можно считать как органическими, так и неорганическими, но в любом случае их получение стало большим шагом вперёд и для теоретической, и для синтетической химии.
Гораздо труднее сдавался криптон. Однако и его удалось сначала соединить со фтором, а затем встроить и в более сложные молекулы.
Не нужно думать, что все эти соединения — некая забавная экзотика. По крайней мере, один класс из них, фториды ксенона и, прежде всего, его дифторид, довольно часто применяют, если в лабораторных опытах нужно что-то профторировать. Работают они и для вскрытия минерального сырья, и, естественно, как промежуточные соединения при синтезе новых производных ксенона.
В целом „бартлеттовское“ направление в химии инертных газов имеет две главные особенности. Во-первых, оно принадлежит к ионной химии. Так, формулу первого соединения ксенона правильнее записывать как Xe + [PtF 6] –. Во всех случаях инертный газ служит восстановителем. Это понятно из самых общих соображений: при всём желании атом с заполненной электронной оболочкой не способен принять ещё один электрон, а вот отдать — может. Главное, чтобы партнёр был агрессивен и настойчив, то есть обладал ярко выраженными окислительными свойствами. Неудивительно, что легче других расстаётся со своим „октетным благородством“ ксенон: у него электроны внешней оболочки расположены дальше от ядра и удерживаются слабее.
Во-вторых, современная химия инертных газов тесно привязана к химии фтора. В состав подавляющего большинства соединений входят атомы фтора, и даже в тех редких случаях, когда фтора нет, путь к их получению всё равно лежит через фториды.
А может ли быть иначе? Существуют ли соединения инертных газов не только без фтора, но и без каких-либо других окислителей? Например, в виде нейтральных стабильных молекул, где атом инертного газа связан с водородом и ни с чем больше? До недавнего времени такой вопрос, повидимому, даже не приходил в голову ни теоретикам, ни экспериментаторам. Между тем именно о таких молекулах речь пойдёт дальше.
Лирическое отступление о роли благородства
Прежде чем говорить о гидридах инертных газов, давайте вернёмся к самому началу, а именно — к инертности благородных газов. Несмотря на всё сказанное выше, элементы главной подгруппы восьмой группы вполне оправдывают своё групповое название. И человек использует их естественную инертность, а не вынужденную реакционную способность.
Например, физико-химики любят применять такой метод: заморозить смесь инертного газа с молекулами какого-либо вещества. Остыв до температуры между 4 и 20К, эти молекулы оказываются в изоляции в так называемой матрице твёрдого инертного газа. Далее можно действовать светом или ионизирующим излучением и смотреть, что за промежуточные частицы получаются. В других условиях такие частицы не видны: они слишком быстро вступают в реакции. А с инертным газом, как считалось в течение многих лет, прореагировать очень непросто. Такими исследованиями на протяжении многих лет занимались в наших лабораториях — в Научно-исследовательском физико-химическом институте им. Л.Я. Карпова, а затем и в Институте синтетических полимерных материалов РАН, причём использование матриц с различными физическими свойствами (аргона, криптона, ксенона) рассказало много нового и интересного о влиянии окружения на радиационно-химические превращения изолированных молекул. Но это — тема для отдельной статьи. Для нашей же истории важно, что такая матричная изоляция неожиданно для всех привела в совершенно новую область химии инертных газов. И случилось это в результате одной встречи на международной конференции по матричной изоляции в США, которая произошла в 1995 году. Именно тогда научный мир впервые узнал о существовании новых необычных соединений ксенона и криптона.
Гидриды выходят на сцену
Финские химики из Университета Хельсинки Мика Петтерсон, Ян Лунделл и Маркку Расанен наполняли твёрдые матрицы инертных газов галогеноводородами (HCl, HBr, HI) и смотрели, как эти вещества распадаются под действием света. Как оказалось, если ксеноновую матрицу после лазерного фотолиза, который проводили при температуре ниже 20К, нагреть до 50К, то в ней появляются новые и очень интенсивные полосы поглощения в ИК-спектре в области между 2000 и 1000 см –1. (В классической колебательной спектроскопии, в „среднем“ и „дальнем“ ИК-диапазонах, традиционно используют шкалу волновых чисел — эквивалентов частот колебаний, выраженных в обратных сантиметрах. Именно в таком виде характеристики колебательных спектров приведены почти во всех учебниках, справочниках и статьях.) В криптоновой матрице этот же эффект проявлялся после нагрева до 30К, а в аргоновой никаких новых полос заметно не было.
Исследователи из Хельсинки сделали смелое предположение: поглощение обусловлено валентными колебаниями связей H–Xe и H–Kr. То есть при нагреве облучённых образцов возникают новые молекулы, содержащие атомы инертных газов. Эксперименты с изотопным замещением и квантово-химические расчёты полностью подтвердили эту догадку. Таким образом, семейство соединений инертных газов пополнилось сразу несколькими новыми членами весьма необычного вида — HXeCl, HXeBr, HXeI, HKrCl и HXeH. Последняя из перечисленных формул произвела особенно сильное впечатление на химиков, воспитанных на классических традициях: только ксенон и водород, никаких сильных окислителей!
Здесь важно отметить: для того чтобы новое соединение появилось на химической карте мира, необходимо его однозначно идентифицировать. Расанен и его коллеги решились поверить своим глазам, рискнули высказать смелое предположение и смогли доказать его. Между тем подобные эксперименты с инертными матрицами проводили и другие учёные. Вполне вероятно, что они наблюдали полосы поглощения гидридов ксенона и криптона, но не смогли их опознать. Во всяком случае, дигидрид ксенона несомненно получался в наших экспериментах, только мы об этом не подозревали. Зато, рассматривая вместе с финскими коллегами наш стенд на той самой конференции, где были впервые представлены сенсационные данные хельсинкской группы, мы сразу же это соединение смогли обнаружить. В отличие от финских коллег, мы в ксеноне замораживали углеводороды, а потом облучали их быстрыми электронами. Гидрид же возникал при нагреве до 40К.
Образование нового, столь необычного соединения инертного газа именно при нагреве означает: всё дело во вторичных реакциях. Но какие частицы в них участвуют? На этот вопрос первые эксперименты ответа не давали.
Метастабильная связь в газовом льду
Следуя „ионной традиции“ в химии ксенона, финские исследователи предположили, что и здесь предшественниками служат ионные частицы — протоны и соответствующие анионы. Проверить это предположение, опираясь только на данные ИК-спектроскопии, было невозможно, ведь полосы в спектрах при нагреве появлялись внезапно, как будто из ничего. Однако в нашем распоряжении был ещё метод электронного парамагнитного резонанса (ЭПР). С его помощью удаётся определить, что за атомы и радикалы возникают при облучении и как быстро они исчезают. В частности, атомы водорода в ксеноновой матрице дают прекрасные сигналы ЭПР, которые ни с чем нельзя спутать вследствие характерного взаимодействия неспаренного электрона с магнитными ядрами изотопов ксенона (129Xe и 131Xe).
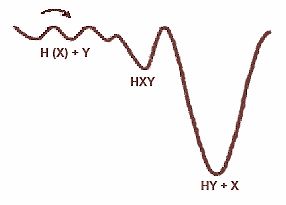
Примерно так выглядят блуждания атомов водорода по энергетическим ямам: глобальный минимум, отвечающий молекуле HY, лежит намного ниже, но барьер между двумя состояниями оказывается достаточно большим, чтобы обеспечить относительную устойчивость промежуточного соединения с участием инертного газа.
Вернувшись с памятной конференции 1995 года, мы сразу же провели эксперименты, где и выяснили, что при нагреве ксеноновой матрицы атомы водорода исчезают. Причём их гибель, зафиксированная по данным ЭПР, хорошо коррелирует с возникновением дигидрида ксенона, о котором свидетельствуют ИК-спектры: оба процесса протекают в очень узком диапазоне температур (38–40К). Если же в матрицу добавить вещества, которые подавляют образование атомов водорода при облучении, то и выход дигидрида ксенона при последующем нагреве резко снижается. То есть дело вовсе не в ионах-предшественниках, о которых думали финны: молекула HXeH возникает в результате реакций подвижных атомов водорода. Когда два атома сближаются в матрице настолько, что между ними остаётся лишь один атом ксенона, вместо привычной рекомбинации с образованием Н 2 возникает молекула нового соединения. Финские учёные, в свою очередь, обнаружили, что и HXeI образуется схожим образом.
В результате этих экспериментов получилась схема образования гидридов инертных газов в ксеноновых и криптоновых матрицах. Она выглядит так. Когда твёрдую матрицу достаточно нагреют (до 30–32К для криптона или 38–40К для ксенона), замороженные ранее атомы водорода начинают диффундировать, то есть прыгают от одной ловушки к другой. И делают это до тех пор, пока ловушка не окажется слишком глубокой. Один из глубоких локальных минимумов энергии соответствует молекуле HXY, где Y — второй водород или какой-то галоген, а X — ксенон или криптон. Этот гидрид, несомненно, метастабилен, ведь глобальный минимум, который отвечает молекуле HY, лежит намного ниже. Однако барьер между двумя состояниями не так уж мал: при столь низкой температуре преодолеть его не удаётся и промежуточное соединение оказывается устойчивым. Во всяком случае, при той температуре, когда инертный газ ещё существует в твёрдом виде.
«Ударная пятилетка» гидридов
Такая схема оказалась неплохим руководством к действию для направленного синтеза новых молекул. Вскоре выяснилось, что в роли Y может выступать любой атом или радикал с относительно высоким сродством к электрону. В течение пяти лет группа Расанена получила целую серию новых гидридов ксенона: HXeCN, HXeNC, HXeSH, HXeOH. Последнее из этих соединений интересно тем, что с формальной точки зрения представляет собой продукт внедрения атома ксенона в молекулу воды. Список криптонсодержащих молекул пополнился двумя соединениями — HKrCN и HKrF. Но, пожалуй, главной сенсацией стало первое нейтральное химическое соединение аргона — HArF: оно возникает при фотолизе фтористого водорода в аргоновой матрице. Отметим, что в получении HArF и других соединений активное участие принимал бывший сотрудник Санкт-Петербургского университета Леонид Хрящев, который работает в группе Расанена с 1996 года. В целом стало окончательно ясно, что в ближайшем будущем школьным учебникам химии не удастся избежать сильной корректировки.
После падения „аргонового бастиона“ для химиков, кажется, не осталось ничего незыблемого. Во всяком случае, теоретики уже всерьёз обсуждают возможность существования молекулы HHeF. Правда, надежда на то, что удастся экспериментально зафиксировать рождение такого соединения, весьма мала: скорее всего, оно будет жить очень недолго — атом водорода просочится под энергетическим барьером и соединится непосредственно со фтором без благородного посредника.
Путь к ксеноноорганике
Синтез гидридов инертных газов был одним из эффектных заключительных достижений химии XX века. И всё же к началу нового столетия эта глава химической истории закончилась. В самом деле, почти все предсказанные простые молекулы HXY были получены. Редкие теоретически устойчивые, но до сих пор не найденные исключения — это — HXeF и HXeSiF 3 или экзотическое соединение гелия. Между тем каждый химик знает, что органических соединений известно во много раз больше, чем неорганических. И возможности для комбинирования здесь почти безграничны.
Можно ли получить органические гидриды инертных газов? Никаких принципиальных препятствий для этого нет: нужно лишь представить, что в роли Y выступает органический радикал, обладающий достаточной электроотрицательностью. Каковы шансы обнаружить их практически? В современной химии расчёт часто предшествует эксперименту, и химия инертных газов здесь не исключение.
Квантово-химические расчёты органических молекул с атомом ксенона, внедрённым по связи О–Н, появились вскоре после открытия первых гидридов.
Рекомендуем скачать другие рефераты по теме: 6 решебник виленкин, культурология.
Категории:
1 2 3 | Следующая страница реферата
 Главная
Главная