Исследование растворимости и ионного обмена как инструмент изучения равновесий в водном растворе
| Категория реферата: Биология и химия
| Теги реферата: реферат экономическое развитие, ответы 11 класс
| Добавил(а) на сайт: Zyrjanov.
Предыдущая страница реферата | 1 2
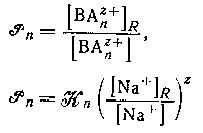 и будет
постоянной при условии, что постоянны значения
и будет
постоянной при условии, что постоянны значения ![]() и отношение концентрации ионов натрия в двух
фазах. Последнее условие выполняется, если водная фаза содержит постоянную
высокую концентрацию ионов натрия и обмен невелик. Подобным образом, если
вероятен гидролиз группы В в смоле или в растворе, то достаточно использовать
смолу в водородной форме и сильную кислоту в качестве фонового электролита.
Использование постоянной ионной среды также обеспечивает постоянство
коэффициентов активности в водной фазе.
и отношение концентрации ионов натрия в двух
фазах. Последнее условие выполняется, если водная фаза содержит постоянную
высокую концентрацию ионов натрия и обмен невелик. Подобным образом, если
вероятен гидролиз группы В в смоле или в растворе, то достаточно использовать
смолу в водородной форме и сильную кислоту в качестве фонового электролита.
Использование постоянной ионной среды также обеспечивает постоянство
коэффициентов активности в водной фазе.
Томпкинс
и Мэйер нашли, что константа равновесия обмена между ионами лантана и аммония
на смоле Дауэкс 50 достигает постоянной величины при очень низких концентрациях
ионов лантана. Работы Фронеуса по ацетатным системам меди и никеля указывали на
то, что при постоянной и очень малой загрузке смолы значения К зависят от
концентрации свободных ацетат-ионов в водной фазе. Это означает, что, несмотря
на разные заряды, формы В2+ и ВА+ действуют одинаково на коэффициенты
активности в фазе смолы при условии, что они присутствуют только в небольших
концентрациях. Поэтому Фронеус рекомендует получать количественные сведения о
комилексообразованиии полной фазе на основе измерений, которые относились бы к
постоянным и очень небольшим загрузкам смолы. Поэтому ионообменный метод не
пригоден для количественного изучения систем, в которых образуются полиядерные
формы. Для того чтобы обеспечить независимость констант ![]() от
концентрации водородных ионов раствора, следует использовать сильнокислую
однофункцнональную смолу, такую, как сульфированный полистирол (например, Дауэкс 50, Цеокарб 225 или Амберлит 120). Дальнейшим недостатком слабокислых
смол, содержащих фенольные группы, является их тенденция к восстановлению
поглощенных форм (например, иона VО2+ ). Если используются сильнокислые
обменники при малой и постоянной загрузке, то коэффициенты активности в фазе
смолы и отсюда стехиометрический коэффициент распределения между смолой и
постоянной ионной средой будут оступаться постоянными.
от
концентрации водородных ионов раствора, следует использовать сильнокислую
однофункцнональную смолу, такую, как сульфированный полистирол (например, Дауэкс 50, Цеокарб 225 или Амберлит 120). Дальнейшим недостатком слабокислых
смол, содержащих фенольные группы, является их тенденция к восстановлению
поглощенных форм (например, иона VО2+ ). Если используются сильнокислые
обменники при малой и постоянной загрузке, то коэффициенты активности в фазе
смолы и отсюда стехиометрический коэффициент распределения между смолой и
постоянной ионной средой будут оступаться постоянными.
Общее предположение, что только положительно заряженные формы сорбируются на катионите, было проверено на системе оксалата магния. Если оно справедливо в любом случае,- то распределение центральной группы между катионитом и раствором определяется выражением
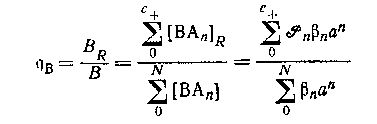
при условии, что коэффициенты активности в обоих фазах соответственно контролируются. Метод ограничивается системами комплексов катионных центральных групп с отрицательно заряженными лигандами.
Катионный обмен не является ни относительно точным, ни относительно удобным методом для определения констант устойчивости большинства систем. Функцию nв(а) невозможно определить с такой же точностью, которую часто получают в потенциометрии, а интерпретация данных включает (с++1) параметров в дополнение к искомым величинам βn.Так как В не может меняться в большой области концентраций, то этот метод ограничивается моноядерными системами. Более того, возникают заметные изменения nв от а, если лигандом является анион. Однако метод пригоден для изучения систем, в которых В следует сохранять очень низким (например, вследствие образования полиядерных форм при макроконцентрациях или из-за большой радиоактивности или недостаточного количества группы В). Наиболее удобно, когда происходит распределение только центральной группы, но для катионного обмена были получены обнадеживающие результаты, которые согласуются с данными других методов в системах с с+>0.
Анионный обмен
Анионный обмен, так же как и катионный, может быть применен для изучения комплексообразования между положительно заряженной центральной группой и отрицательно заряженным лигандом. Однако его использование осложнено тем, что в добавление к анионным комплексам на смоле также адсорбируются лиганд и анион фонового электролита. Поэтому состав обменника и, следовательно, коэффициенты активности в фазе смолы будут сильно меняться в зависимости от состава водной фазы, если в макроконцентрации присутствует более чем один тин аниона. В таких случаях коэффициент распределения является чрезвычайно сложной функцией от а. Поэтому для изучения анионного обмена нельзя применять фоновый электролит, если лиганд не присутствует в микроконцептрациях. Но часто оказывается, что для образования анионных комплексов необходимы высокие концентрации свободного лиганда. В благоприятных случаях коэффициенты активности в обменнике можно считать постоянными, если используются следовые концентрации группы В и если обменник насыщен лигандом. Однако анионообменный метод имеет тот большой недостаток, что поскольку не может быть использована постоянная ионная среда, то нельзя контролировать коэффициенты активности в водной фазе.
Фронеус был первый, кто попытался количественно обработать результаты анионного обмена для комплексов металлов. Его метод был значительно расширен Маркусом и Корьеллом, Фоминым к его сотрудниками. Адсорбцию анионного комплекса ВАС можно представить реакцией
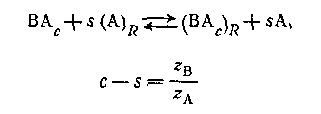 для комплексов с центральной группой В z в+ и
лигандом Аz А-. Коэффициент распределения центральной группы между обменником и
водным раствором определяется уравнением
для комплексов с центральной группой В z в+ и
лигандом Аz А-. Коэффициент распределения центральной группы между обменником и
водным раствором определяется уравнением
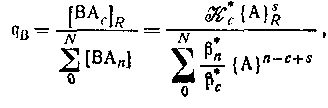
где
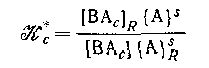
является смешанной константой обмена реакции и
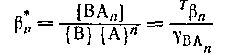 является смешанной константой устойчивости
формы ВAn.
является смешанной константой устойчивости
формы ВAn.
Список литературы
Бек Н. Химия равновесия реакций комплексообразования. М.Мир. 1973.
Белеванцев В.Н., Пещевицкий Б.Н. Исследование сложных равновесий в растворе. Новосибирск. Наука, 1978.
Россотти Ф,, Россотти X. Определение констант устойчивости и других констант равновесия в растворах. М. Мир. 1965.
Новоселова А.В. Методы исследования гетерогенных равновесий. М., Высшая школа. 1980.
Скачали данный реферат: Curinov, Исмайлов, Domna, Olimpij, Балтабев, Nastasija.
Последние просмотренные рефераты на тему: дипломная работа по менеджменту, население реферат, контрольная 1, реферат.
Категории:
Предыдущая страница реферата | 1 2
 Главная
Главная