
Изоморфизм уравнений диссипативных свойств растворов электролитов
| Категория реферата: Биология и химия
| Теги реферата: решебники 10, реферат на тему творчество
| Добавил(а) на сайт: Shibalov.
1 2 3 4 5 6 7 8 9 10 11 | Следующая страница реферата
Изоморфизм уравнений диссипативных свойств растворов электролитов
Асеев Д.Г.
Аннотация
Показана принципиальная возможность объединения таких диссипативных свойств, как электропроводность, вязкость и диффузия растворов электролитов.
![]()
На основе этого равенства теоретически получены значения диффузии D, и вязкости растворов электролитов (LiCl, NaCl, KCl) исходя из значений электропроводности, до концентраций насыщенных растворов.
Введение.
Растворы электролитов, в значительной мере определяющие уровень современной химической технологии, продолжают оставаться предметом многочисленных исследований с применением всего арсенала теоретических и экспериментальных методов. Благодаря требованиям практики изучению растворов всегда уделялось и уделяется большое внимание, так как большинство химических реакций, используемых в химической, фармацевтической, пищевой, металлургической и других отраслях промышленности, проходит в растворах.
Все биологические процессы в растительных или животных организмах, в том числе и в организме человека, совершаются в растворах. Это же относится и к процессам, происходящим в почве. Поэтому прогресс таких наук, как биология, медицина, почвоведение и т. д., тесно связан с развитием учения о растворах.
Оптимизация существующих технологий и создание новых требуют в каждом случае сведений о механизмах элементарных процессов, их проявлений в макроскопических неравновесных условиях и т.д.
Огромный экспериментальный материал по свойствам растворов электролитов, накопленный к настоящему времени, нуждается в теоретических обобщениях, удовлетворяющих в той или иной степени, реальным взаимодействиям на микроскопическом уровне.
При этом значительные усилия затрачиваются на исследование индивидуальных характеристик ионов в растворах и их кинетических свойств, называемых иногда транспортными или диссипативными. К последним относят электропроводность, диффузию, вязкость и теплопроводность растворов электролитов.
По очевидным причинам, кинетические свойства определяются преимущественно энергией многочастотных взаимодействий ионов в диэлектрической среде. А это предполагает однозначно привлечение индивидуальных характеристик, как сольватные числа, массы сольватированных ионов, энергии межмолекулярных взаимодействий растворителя, коэффициентов активности, размеров сольватированных ионов. По ряду позиций, экспериментальное определение невозможно в принципе (условие электронейтральности), вероятны лишь теоретические оценки, либо полуэмпирические обработки экспериментального материала на основе ряда правдоподобных, но произвольных по существу, допущений.
Что касается вязкости и диффузии растворов электролитов, то соотношения Эйнштейна, Стокса и Фика дают соответствие с экспериментом лишь в области малых концентраций. Причина – отсутствие приемлемой аппроксимации подвижности ионов и их линейных размеров в условиях сольватации.
Фактический экспериментальный и теоретический материал преимущественно относится к водным разбавленным растворам электролитов. При этом отсутствуют систематические сведения в концентрированных растворах. Наличие широкого спектра методов исследований предопределяет существенную неопределенность при использовании для реальных задач литературных сведений.
Приведенный, далеко не полный перечень сложностей теории растворов электролитов, представляет собой сугубо качественный аспект проблемы системы зарядов в диэлектрических средах.
В последнее время для водных растворов электролитов показана перспективность использования плазмоподобного состояния ионов в растворах, для оценок индивидуальных характеристик от нулевых концентраций до насыщенных водных растворов в удовлетворительном соответствии с экспериментом. Это было достигнуто за счет применения формального аппарата плазмы в более строгом смысле, чем в электростатической теории Дебая – Хюккеля, где понятие плазмы лишь введено в теорию, но нераскрыто по существу.
Принципиальная возможность использования плазменной концепции состояния растворов электролитов отмечена в работах М.М. Балданова [М.М. Балданов. Изв. Вузов. Серия хим. и хим. технология. 1986, т.29, вып. 8, с.38-44 (“Приближение ионной плазмы в теории растворов электролитов”); М.М. Балданов, М.В. Мохосоев. ДАН СССР. 1985, т.284, вып.6, с. 1384-1387 (“Состояние ионов в растворах электролитов в приближении ионной плазмы”)]
Основная задача данной работы заключается в определении концентрационных зависимостей диффузии и вязкости растворов электролитов исходя из данных электропроводности полученных экспериментально или теоретически, и сравнении результатов с табличными данными, при постоянной температуре.
Причина подобного подхода к определению диффузии и вязкости кроется в погрешностях экспериментальных определений, например, коэффициент диффузии дается в справочной литературе с погрешность достигающей 15%, вязкость определяется с погрешностью до 5%, а электропроводность определяют довольно с большой точностью, порядка 0,05 – 0,08%.
Объектами исследования было решено выбрать водные растворы хлоридов щелочных металлов: LiCl, NaCl, KCl, поскольку они наиболее изучены и данные по электропроводности, диффузии и вязкости этих растворов наиболее доступны.
Справедливость теоретических моделей и их параметров подтверждаются результатами расчетов. Во всех случаях наблюдается удовлетворительное соответствие оценочных величин с экспериментальными данными в более широком диапазоне изменения концентрации, чем в соответствующих теориях. При этом соблюдается концептуальное единство для всех диссипативных процессов, позволяющее оценивать вязкость и коэффициент диффузии без экспериментальных методов по данным эквивалентной электропроводности, исключая возможность введения тех или иных подгоночных параметров, что имеет теоретический интерес и практическое значение.
2. Современное представление электропроводности растворов
В работах [1 - 6] предложена теоретическая модель многочастотных взаимодействий ионов в растворах электролитов и выведено уравнение электропроводности.
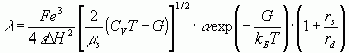 (1)
(1)
Которое
получается из двух эквивалентных представлений потока ![]() и
и ![]() . Прировняв по
j и выразив получим
. Прировняв по
j и выразив получим ![]() .
.
Здесь
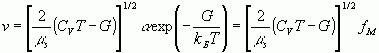 (2)- скорость
ионов (fM – максвелловское распределение по скоростям [7]),
(2)- скорость
ионов (fM – максвелловское распределение по скоростям [7]),
![]() (3)- напряженность
внешнего электрического поля,
(3)- напряженность
внешнего электрического поля,
Рекомендуем скачать другие рефераты по теме: quality assurance design patterns системный анализ, курсовики скачать бесплатно.
Категории:
1 2 3 4 5 6 7 8 9 10 11 | Следующая страница реферата
 Главная
Главная