
Общие свойства аминокислот
| Категория реферата: Биология и химия
| Теги реферата: бесплатные банки рефератов, реферат на тему предприятие
| Добавил(а) на сайт: Кирилла.
1 2 | Следующая страница реферата
Общие свойства аминокислот
Березов Т.Т., Коровкин Б.Ф.
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде недиссоциированных молекул (последнюю структуру приводят для удобства представления, однако все аминокислоты при физиологических значениях рН имеют структуру цвиттериона).
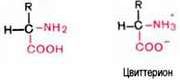
При растворении в воде кристаллическая аминокислота, например аланин, может реагировать или как кислота (донатор протона):
![]()
или как основание (акцептор протона):
![]()
Если радикалы аминокислот нейтральные, то они почти не оказывают влияния на диссоциацию α-карбоксильной группы или α-аминогруппы, и величины рК (отрицательный логарифм константы диссоциации) остаются относительно постоянными. Вследствие этого кривые диссоциации почти всех нейтральных аминокислот накладываются друг на друга и могут быть рассмотрены на примере аланина. Если к раствору аланина (например, 0,1 М) в воде постепенно прибавлять сильную кислоту (0,1 М раствор НСl) или сильную щелочь (0,1 М раствор NaOH), то получим кривую титрования аланина, типичную для всех нейтральных аминокислот (рис. 1.6).
Кажущиеся величины рК' для α-карбоксильной группы и α-аминогрупп (т.е. значения рН, при которых эти группы в среднем наполовину диссоциированы) довольно сильно различаются, составляя pK1 = 2,34 и рК2 = 9,69. При низком значении рН (ниже pK1') почти все молекулы аланина являются полностью протонированными и несут положительный заряд. Другими словами, при высокой концентрации водородных ионов в растворе тенденция к диссоциации водорода из структуры аланина оказывается незначительной. Из кривой титрования видно, что точка перехода между ветвями кривой располагается при рН 6,02. Это означает, что при данном значении рН суммарный (или средний) электрический заряд молекулы аланина равен нулю и она не перемещается в электрическом поле ни к аноду, ни к катоду (изоэлектрическое состояние). Такое значение рН получило название изоэлектрической точки и обозначается pI. Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК':
![]()
соответственно для аланина
![]()
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы (аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин и др.), зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, рI должна вычисляться из полусуммы значений рК' для α- и ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. Следует отметить, что при физиологических значениях рН тканей и крови (7,1 и 7,4 соответственно) аминокислоты (за ислючением гистидина) не обладают измеримой буферной емкостью. Эту способность они приобретают только при значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8).
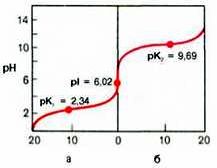
Рис. 1.6. Кривые, полученные при титровании 0,1 М раствора аланина 0,1 М раствором НСl (а) и 0,1 М раствором NaOH (б).
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Будучи растворенными в воде (или в НСl), они способны вращать плоскость поляризованного луча (исключение составляет глицин). Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями). Величины удельного вращения вправо или влево являются количественной характеристикой оптической активности, и для большинства аминокислот [а]2р составляет от 10 до 30°. Примерно половина аминокислот белков оказалась правовращающей, их обозначают знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины - левовращающей (Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическое вращение.
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
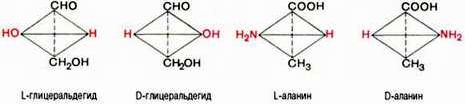
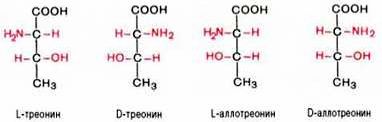
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида. Следует еще раз подчеркнуть, что символы L и D означают принадлежность данной аминокислоты по своей стереохимической конфигурации к L- или D-ряду, в то время как знак «+» или «–» указывает на направление изменения плоскости поляризации светового луча. Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно получить четыре стереоизомерные формы этих аминокислот . Для треонина известны все четыре изомера. Если условно обозначить символом L выделенный из природных белков треонин, то его зеркальное отображение называют D-треонином. Два других изомера, получивших наименование диастереоизомеров, или аллоформ, также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров треонина можно представить следующими формулами:
Как отмечалось, в белковой молекуле D-аминокислоты не обнаружены , однако в живой природе они широко распространены.
Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий; в составе некоторых антибиотиков, в частности актиномицинов, бацитрацина, грамицидинов А и S, содержатся аминокислоты D-конфигурации.
Аминокислотный состав (качественный и количественный) многих тысяч белков, полученных из разных источников, выяснен (табл. 1.4).
При анализе данных табл. 1.4 виден ряд закономерностей. На долю дикарбоновых аминокислот и их амидов в большинстве белков приходится до 25–27% всех аминокислот. Эти же аминокислоты вместе с лейцином и лизином составляют около 50% всех аминокислот. В то же время на долю таких аминокислот, как цистеин, метионин, триптофан, гистидин, приходится не более 1,5–3,5%. В протаминах и гистонах отмечено высокое содержание основных аминокислот аргинина и лизина, соответственно 26,4 и 85,2% (см. «Химия простых белков»).
Химические реакции для открытия и определения аминокислот в гидролизатах белков. В курсе органической химии подробно рассмотрено множество химических реакций, характерных для α-амино- и α-карбоксильных групп аминокислот (ацилирование, алкилирование, нитрование, этерификация и др.). Здесь будут рассмотрены общие цветные реакции для обнаружения индивидуальных аминокислот и аминокислот, входящих в состав белков, основанные на химической природе радикалов аминокислот (табл. 1.5).
Рекомендуем скачать другие рефераты по теме: матершинные частушки, решебники за 8 класс.
Категории:
1 2 | Следующая страница реферата
 Главная
Главная