нормальное
состояние возбужденное состояние
Таким образом, у атома углерода, участвующего в
образовании четырех ковалентных связей, во внешнем электронном слое, как было
показано ранее, четыре валентных электрона. Состояние их не одинаково. Один из
них (s- электрон), двигаясь вокруг ядра образует шаровое облако (рис.3), подобное облаку электрона в атоме водорода (s-состояние электрона). Облака трех
других электронов (p- электроны) имеют форму объемных восьмерок (гантелей) с
"перетяжкой" в области ядра и ориентированных в трех взаимно
перпендикулярных направлениях (p- состояния электрона).
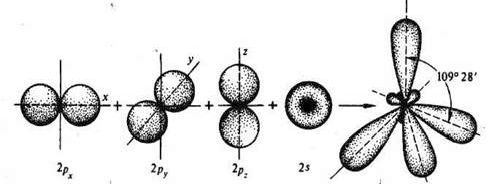
Рис. 3. Негибридизованные 2р(x y z) (а, б, в) и 2s
орбитали (г) атома углерода и орбитали атома углерода в состоянии sp3-гибридизации
(д).
Когда углерод, проявляя валентность четыре, соединяется простыми (ординарными) связями с четырьмя другими атомами, электронная плотность облаков всех четырех валентных электронов
перераспределяются. Происходит гибридизация одного s- состояния и трех p-
состояний электронов. В результате во внешнем электронном слое связанного
углеродного атома возникают четыре одинаковых гибридных состояния. Занимая эти
состояния, валентные электроны образуют гибридные облака, имеющие вид
деформированной восьмерки (Рис.3 д), большая часть которой направлена от ядра
по линии связи с другим атомом.
Такое состояние валентных электронов атома углерода
называют sp3- гибридизацией (первое валентное состояние углерода). Все четыре
гибридных облака имеют определенную направленность в пространстве под углом
109о28' друг к другу, что соответствует о тетраэдрической направленности связей
атома углерода.
Образование
простых связей
Как показано ранее, простая ковалентная связь между
атомами образуется парой обобщенных электронов. Образование этой пары в свете
представлений квантовой механики заключается во взаимном перекрывании облаков
электронов, осуществляющих связь; перекрывание происходит при сближении атомов
на определенное расстояние. Между этими атомами на прямой, соединяющей их
центры, возникает наибольшая электронная плотность (область максимального
перекрывания облаков). К этой области повышенной плотности отрицательного
заряда притягиваются положительно заряженные ядра атомов, следствием чего и
является возникновение химической cвязи.
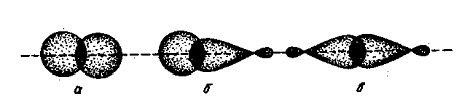
На рис. 4 представлены схемы образования некоторых
связей. Простая связь между атомами водорода и углерода H-C (или H:C) является
следствием перекрывания шарообразного облака электрона атома водорода и
гибридного облака одного из валентных электронов атома углерода. Простая связь
между двумя углеродными атомами C—C (или C:C) осуществляется вследствие
перекрывания двух гибридных облаков углеродных атомов.
Рис. 4. Различные виды перекрывания орбиталей при образовании
s-связей: а- перекрывания 1s - орбиталей атомов водорода
(Н — Н);
б- перекрывание 1s-орбитали атома водорода с гибридной
орбиталью атома углерода (С—Н); в- перекрывание двух гибридных орбиталей атомов
углерода (С—С).
Связи указанного типа, в которых максимальное
перекрывание электронных облаков осуществляется на линии между центрами атомов, называются s-связями, а электроны, участвующие
в их образовании, s - электронами. Каждая ковалентная связь характеризуется определенным
расстоянием между ядрами соединенных атомов. Это расстояние называется
межъядерным расстоянием, или длиной связи. Длина простой связи C—C составляет
1,54 А (0,154 нм).
Образование
двойных связей
Двойная связь, например связь C=C, образована двумя
обобществленными электронными парами C::C. Но состояние каждой из них не
одинаково. Например, в молекуле этилена H2C=CH2 при образовании двойной связи в
каждом из атомов углерода образуется лишь три гибридных состояния - в
результате гибридизации s- состояния и двух p- состояний (sp2- гибридизация). В
этом случае у каждого углеродного атома одно из p- состояний не участвует гибридизации
и остается неизменным.
Три гибридных облака каждого из углеродных атомов
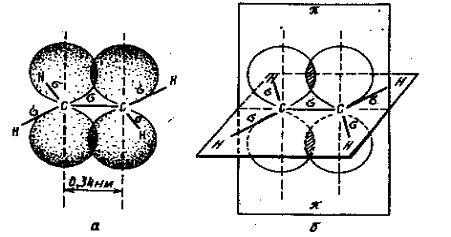
этилена участвуют в образовании трех s-связей (второе валентное состояние углерода). В
этилене всего пять s-связей (четыре C—H и одна С—С). Все они расположены в одной плоскости, каждая под углом 120о к соседней связи (рис. 5):
Таким образом, одна из электронных пар двойной связи
между атомами углерода осуществляют обычную s-связь, вторая электронная пара образуется электронами
не участвующими в гибридизации и сохранившими p-состояние. Облака этих
электронов, сохранившие форму объемных восьмерок, направлены перпендикулярно к
плоскости, в которой расположены s-связи молекулы этилена и перекрываются над и под этой
плоскостью.
Рис. 5. Перекрывание двух негибридизованных
2р-обриталей в молекуле этилена: а- объемное изображение перекрывающихся
негибридизованных 2р-орбиталей; б- схематическое изображение этих орбиталей на
плоскости.
Связь, осуществляемую такой парой электронов, называют
p-связью, а образующие ее
электроны - p- электронами. Как показано
на рис. 6 , p-связь возникает в
плоскости, перпендикулярной плоскости расположения s-связей.
Двойная связь, являющаяся сочетанием s- и p-связей, по характеру существенно отличается от простой связи. Центры
углеродных атомов в этилене находятся на расстоянии 1,34 А (0,134 нм), т.е.
длина двойной связи несколько меньше, чем простой.
Образование
тройных связей
Тройная связь CºC образована тремя парами обобществленных электронов C:::C.
Состояние этих пар не одинаково, так же как в случае двойной связи. Одна из них
представляет собой s-связь, две другие - p-связи. Поясним это на примере ацетилена HCºCH. При образовании тройной связи в каждом углеродном
атоме гибридизируется одно s- и одно p- состояния электронов (sp-гибридизация).
У каждого углеродного атома образуется два гибридных состояния, а два p-
состояния не участвуют в гибридизации и сохраняют свою конфигурацию (рис. 6).
Два гибридных облака каждого атома С в ацетилене
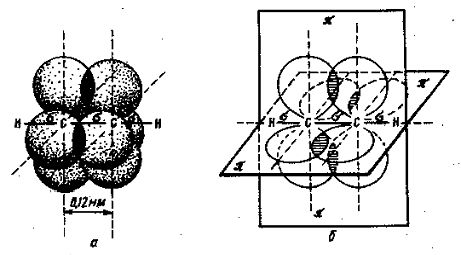
участвуют в образовании двух s-связей (третье валентное состояние углерода). В ацетилене всего три s-связи (одна C—C и две C—H), расположенные на одной
прямой. В результате же перекрывания облаков электронов, сохранивших p-состояние, возникают две p-связи, образованны и двух взаимно перпендикулярных плоскостей (рис.
6). Тройная связь в ацетилене имеет длину 1,20 А (0,120 нм), т.е. углеродные
атому сближены еще больше, чем в случае двойной связи.
Рис. 6. Перекрывание четырех негибридизованных
2р-орбиталей в молекуле ацетилена: а- объемное изображение четырех
перекрывающихся 2р-орбиталей; б- схематическое изображение этих орбиталей в
двух взаимно перпедикулярных плоскостях.
Изомерия
Еще в 1814 г. французский ученый Гей-Люссак установил, что некоторые вещества при одном и том же качественном и количественном составе
обладают различными физическими и химическими свойствами. Например, состав
C2H6O и, соответственно, молекулярный вес 46,07 имеют два различных изомерных
органических вещества: этиловый спирт – жидкость, кипящая при 78,4 оС, смешивающаяся с водой в любых соотношениях, и диметиловый эфир – газ, почти не
растворимый в воде и существенно отличающийся от этилового спирта по химически
свойствам.
Рекомендуем скачать другие рефераты по теме: шпаргалка рф, цель курсовой работы.
Предыдущая страница реферата |
1
2
3
4
5
6
7
8
9
10
11 |
Следующая страница реферата


 Главная
Главная