
Синтез хлорида олова (IV)
| Категория реферата: Биология и химия
| Теги реферата: доклад по обж, реферат
| Добавил(а) на сайт: Majsak.
1 2 3 4 5 6 7 8 | Следующая страница реферата
Синтез хлорида олова (IV)
Курсовая работа
Выполнил: студент группы 430441 Бут С.Ю.
Государственное образовательное учреждение высшего профессионального образования Тульский государственный университет
Кафедра химии
Тула 2005
Введение.
В этой работе рассмотрены свойства хлорида олова (IV), методы синтеза и применение. Хлорид олова (IV) – вещество, необходимое в неорганическом синтезе; в данный момент в лаборатории отсутствует. Таким образом, основной целью этой работы является синтез хлорида олова (IV).
Литературный обзор.
I. Галогениды олова.
Тетрагалогениды.
Известны все четыре тетрагалогенида олова (табл. 1). Молекулы SnX4 представляют собой правильные тетраэдры с атомом Sn в центре. Все тетрагалогениды олова, кроме SnF4, не содержат мостиковых атомов галогена, благодаря чему эти соединения легкоплавки и легколетучи. В тетрафториде SnF4 имеются октаэдрические фрагменты SnF6, образующие слои за счет мостиковой функции четырех (экваториальных) атомов фтора (олово(IV) имеет КЧ = 6). Естественно, что мостиковый характер SnF4 и больший ионный вклад в связь Sn—F по сравнению со связью Sn—X в других тетрагалогенидах приводит к существенно большей прочности кристаллической структуры SnF4 (температура возгонки 705 °С). [1]
Фторид SnF4 — бесцветное кристаллическое вещество, растворяется в воде с большим выделением тепла. С водными растворами фторидов образуются фторостаннаты (ЩЭ)2[SnF6].
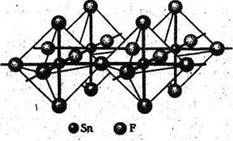
Рис. 1. Структура SnF4
Тетрахлорид SnCI4 — бесцветная, дымящая на воздухе подвижная жидкость, растворяется в неполярных органических растворителях, с бензолом и сероуглеродом смешивается в любых отношениях. Тетрахлорид олова растворяет серу, фосфор, иод, тетраиодид олова. При растворении в воде SnCI4 подвергается гидролизу с образованием SnO2 • xH2O и гексахлорооловянной кислоты H2[SnCl6]:
3SnCl4 + 2H2O = SnO2 + 2H2[SnCl6].
Последнюю можно выделить из раствора в виде кристаллогидрата состава H2[SnCl6] • 6Н2О. Гексахлорооловянная кислота является сильной кислотой; растворы ее солей, благодаря отсутствию гидролиза, имеют нейтральную реакцию и не разрушаются даже при кипячении.
Из водного солянокислого раствора тетрахлорида олова можно выделить кристаллогидрат SnCl4 • 5Н2О в виде белых легко расплывающихся кристаллов. Кристаллогидрат SnCl4 • 5Н2О, по-видимому, следует рассматривать как комплексное соединение H2[SnCl4(OH)2] • ЗН2О, устойчивое в присутствии НС1, которая подавляет гидролиз SnCl4. Известны также соли состава (ЩЭ)[SnCI5] с тригонально-бипирамидальным анионом.
Тетрабромид SnBr4 — бесцветное кристаллическое вещество, растворимое в ацетоне и трихлориде фосфора РС13, в водном растворе гидролизуется, но из кислых растворов удалось выделить кристаллогидрат SnBr4*4H2O. Получены также гексабромооловянная кислота H2[SnBr6] и ее соли.
Тетраиодид SnI4 — желтое кристаллическое вещество, легко растворяется в спирте, эфире, бензоле, сероуглероде; в водном растворе гидролизуется; иодостаннаты состава (ЩЭ)2[SnI6] получены только для рубидия и цезия.
Все SnX4, кроме SnF4, получают взаимодействием олова с избытком галогена:
Sn + 2Х2 = SnX4.
Тетрафторид синтезируют действием безводного фтороводорода на SnCl4.
Известны также смешанные тетрагалогениды олова, например, SnClBr3, SnCl3Br, SnBr2I2, которые по свойствам сходны с «однородными» галогенидами.
Таблица 1.Свойства тетрагалогенидов олова
|
SnX4 |
Tпл, оC |
Ткип, оС |
Цвет Рекомендуем скачать другие рефераты по теме: шпоры по менеджменту, реферат чрезвычайные ситуации. Категории:1 2 3 4 5 6 7 8 | Следующая страница реферата Поделитесь этой записью или добавьте в закладки |
|
 Главная
Главная