
Биосинтез белка и его регуляция
| Категория реферата: Рефераты по биологии
| Теги реферата: информационные рефераты, сочинение 5 класс
| Добавил(а) на сайт: Циглер.
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата
Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяем природу аа¢-тРНКаа¢, которая будет включена в А-центр. аа¢-тРНКаа¢ взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа¢-тРНКаа¢, и ГТФ Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа¢-тРНКаа¢, комплиментарен и антипараллелен кодону мРНК в А-центре. Включение аа¢-тРНКаа¢, в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата
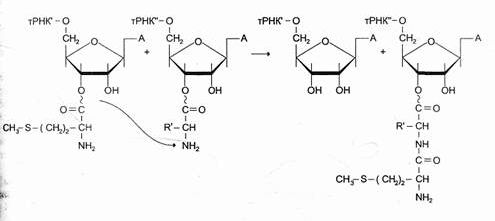
Образование пептидной связи происходит сразу же после отщепления комплекса EF-1 и ГДФ от рибосомы. Эта стадия процесса получила название реакции транспептидации.
В ходе этой реакции остаток метионина аа¢-тРНКаа¢, связывается с a-аминогруппой первой аминокислоты, присоединённой к тРНКаа¢, и pacположенной в А-центре, образуется первая пептидная связь. Установлено, что пептидилтранс|феразная активность большой субъединици рибосомы принадлежит 28S рРНК. К настоящему времени обнаружена целая группа РНК, обладающая свойствами ферментов. Эти каталитически активные РНК получили название рибозимов Полагают, что рибозимы можно считать «реликтами» раннего периода революции, когда белки ещё не приобрели такого значения, как в последующие периоды.
Транслокация — третья стадия элонгации. К рибосоме присоединяется фактор элонгации EF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к З'-концу. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, из А-центра перемещается в Р-центр. Свободная от метионина тРНКаа¢, покидает рибосому, а в область А-центра попадает следующий кодон.
По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в полипептидную цепь второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
Терминация
Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF (от англ, releasing/actor) или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы.
Интересно отметить, что факторы трансляции, реализующие эффекты за счёт гидролиза ГТФ, являются членами суперсемейства G-белков, в которое входят G-белки, участвующие в трансдукции сигналов гормонов и других биологически активных веществ, и Ras-белки, функционирующие как факторы роста. Все G-белки связывают и гидролизуют ГТФ. Когда они связаны с ГТФ, то активны и участвуют в соответствующих метаболических процессах, а когда в активном центре в результате гидролиза ГТФ превращается в ГДФ, эти белки приобретают неактивную конформацию.
Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК рибосому для синтеза белка строго детерминирована мРНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задает структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды «нужные» аа-тРНК, освобождая в ходе элонгаци деацилированные тРНК.
Малая и большая субъединицы рибосомы: процессе трансляции выполняют разные функции: малая субъединица присоединяет мРНК декодирует информацию с помощью тРНК механизма транслокации, а большая субъеданица ответственна за образование пептидных связей.
Полирибосомы
В процессе синтеза белка рибосома присоединяется к 5'-концу мРНК и перемещается в направлении З'-конца. При этом 5'-конец мРНК освобождается, и к нему может присоединиться новая рибосома, на которой начинается poст ещё одной полипептидной цепи. Как правило много рибосом одновременно участвует в синтезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой, или полисомой.
Каждая рибосома занимает на мРНК участок длиной около 80 нуклеотидов, поэтому рибрсомы располагаются на мРНК с интервалом примерно в 100 нуклеотидов. Чем длиннее полипептидная цепочка синтезируемого белка, тем больше рибосом может одновременно осуществлять синтез этого белка, значительно увеличиваая таким образом эффективность использования матрицы.
Каждая рибосома способна катализировать образование около 100 пептидных связей в минуту. Полирибосомы могут существовать в виде частиц, плавающих в цитоплазме клеток, или могут быть связаны с ЭР. Свободные цитоплазматические полирибосомные частицы ответственны за синтез белков, выполняющих внутриклеточные функции. Полирибосомы, ассоциированные с ЭР, под электронным микроскопом имеют вид «шероховатой» поверхности. Белки, синтезируемые «шероховатым» ЭР, должны транспортироваться через мембрану для того, чтобы они достигли места окончательной локализации. Для них характерно присутствие на N-конце лидерной, или сигнальной, последовательности длиной от 15 до 30 аминокислотных остатков, которая содержит много аминокислот с гидрофобными радикалами и обеспечивает прохождение белка через липидный бислой мембран. Некоторые из этих белков для дальнейшего транспорта упаковываются аппаратом Гольджи в секреторные гранулы.
Транспорт синтезированных белков через мембраны.
Помимо использования белков для нужд самой клетки, многие так называемые экспортируемые белки, которые функционируют вне клетки, подвергнутся переносу через клеточную мембрану при помощи особых низкомолекулярных пептидов (от 15 до 30 аминокислот), получивших название лидирующих, или сигнальных, пептидов. Особенностью их состава является преимущественное содержание гидрофобных радикалов, что позволяет им легко проникать через бислойную липидную мембрану или встраиваться в мембрану. Эти сигнальные последовательности в рибосомах образуются первыми с N-конца при синтезе белка по программе сигнальных кодонов, расположенных сразу после инициаторного кодона, и легко узнаются рецепторными участками мембраны эндоплазматической сети. При этом образуется комплекс между мРНК, рибосомой и мембранными рецепторными белками, формируя своеобразный канал в мембране, через который сигнальный пептид проникает внутрь цистерны эндоплазматической сети, увлекая и протаскивая за собой синтезируемую и растущую молекулу секреторного белка. В процессе прохождения или после проникновения полипептида в цистерны N-концевая сигнальная последовательность отщепляется под действием особой лидирующей (сигнальной) пептидазы, а зрелый белок через пластинчатый комплекс (аппарат Гольджи) может покидать клетку в форме секреторного пузырька. Следует указать на возможность активного участия в транспорте белков и других полимерных молекул через мембраны, помимо сигнальных пептидов, также особых белков, получивших наименование поринов; химическая природа и механизм их действия выяснены пока недостаточно.
Синтез митохондриальных белков
В митохондриях клеток высших организмов содержится до 2% клеточной ДНК, отличающейся от ДНК ядра. Митохондрии содержат весь аппарат, включая рибосомы, тРНК и мРН К, необходимый для синтеза определенных белков. Синтезируемые в митохондриях белки в основном относятся к нерастворимым белкам, участвующим в организации структуры этих органелл, в то время как источником синтеза растворимых митохондриальных белков являются рибосомы цитоплазмы, откуда они затем транспортируются в митохондрии. Рибосомы в митохондриях имеют меньший размер чем 80S рибосомы в цитоплазме. Интересно отметить, что в качестве инициирующей аминокислоты при синтезе белка в митохондриях эукариот может участвовать N-формилметионин, а не свободный метионин, как в цитоплазме. Это обстоятельство свидетельствует о том, что митохондриальный синтез белка по своему механизму, очевидно, близок к синтезу белка у прокариот.
Посттрансляционные модификации полипептидной цепи
Полипептидные цепи могут подвергаться структурным модификациям, либо будучи ещё связанными с рибосомами, либо после завершения синтеза. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации.
Многие модификации осуществляются в ЭР. Здесь происходят фолдинг полипептидных цепей и формирование уникальной третичной или четвертичной структуры белков. Причём для поддержания нативной конформации молекул огромное значение имеет правильное формирование дисульфидных связей.
Частичный протеолиз
Многие белки, секретируемые из клеток, первоначально синтезируются в виде молекул-предшественников, функционально неактивных. Удаление части полипептидной цепи специфическими эндопротеазами приводит к образованию активных молекул. Некоторые белки-предшественники расщепляются в ЭР или аппарате ; Гольджи. другие — после секреции. Так, неактивные предшественники секретируемых ферментов — зимогены — образуют активный фермент после расщепления по определённым участкам молекулы: зимоген панкреатической железы трипсиноген превращается в активный трипсин после секреции в тонкий кишечник.
Наглядным примером последовательного двухстадийного протеолиза служит образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов. Первоначально N-концевой сигнальный пептид молекулы-предшественника удаляется в ЭР процессе синтеза белка и образуется неактивный прогормон. Затем прогормон в секреторных гранулах, формирующихся в аппарате Гольджи подвергается действию эндо- и/или экзопротеаз и превращается в активный гормон.
Ковалентные модификации
Структурные белки и ферменты могут акгивироваться или инактивироваться в результате присоединения различных химических групп фосфатных, ацильных. метальных, олигосахаридных и некоторых других.
Фосфорилирование белков осуществляется по гидроксильным группам серина, треонина и, реже, тирозина ферментами из группы протеинкиназ, тогда как дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы
Гликозилирование. Белки, входящие в состав плазматических мембран или секретирующиеся из клеток, подвергаются гликозидированию. Углеводные цепи присоединяются по гидроксильным группам серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и аппарате Гольджи.
Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот: в тиреоглобулине йодируются остатки тирозина; в факторах свёртывания крови карбоксилируются остатки глутамата; в ЭР фибробластов гидроксилируился остатки пролина и лизина в цепях тропоколлагена.
Рекомендуем скачать другие рефераты по теме: реферат предприятие, реферат на тему общество.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата
 Главная
Главная