
Экологическая безопасность при обработке конструкций кондиционеров
| Категория реферата: Рефераты по экологии
| Теги реферата: шпаргалки по педагогике, бесплатные тесты бесплатно
| Добавил(а) на сайт: Крайнев.
Предыдущая страница реферата | 12 13 14 15 16 17 18 19 20 21 22 | Следующая страница реферата
| Вещество | H2O | (H+) H2O | Н2(газ) | О2(газ) | |
| Терм. функция | DG0, кДж/моль | -237,531 | 0 | 0 | 0 |
| DН0, кДж/моль | -286,248 | 0 | 0 | 0 | |
| S°, Дж/моль град | 70,040 | 0 | 130,761 | 205,322 |
Теоретическое напряжение разложения реализуется при совершении системой максимально полезной работы. Оно вычисляется из изменения изобарно-изотермического потенциала при протекании реакции.
DG0 = nFЕт = -Амах,
где DG0 – стандартный изобарно-изотермический потенциал электродной реакции (энергия Гиббса),
DG0 = (Dni DG0 i)п – (Dni DG0 i)р,
где DG0 i – энергия Гиббса образования компонентов реакции
ni - стехиометрический коэффициент компонента реакции. Индекс "п" означает продукты реакции; индекс "р" означает реагенты реакции.
Для реакции на катоде:
DG0к = DG0 н2 – 2DG0 Н+,
DG0к = 0 кДж/моль
Величина стандартного потенциала на катоде:
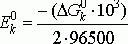 Е0к
= 0
Е0к
= 0
Для реакции на аноде:
В соответствии с правилом термодинамических расчетов, анодную реакцию следует представить в обратном направлении:
1/2O2+2H+ +2ē → H2O. Тогда DG0а = DG0 Н2О – 1/2DG0 О2 – 2DG0 Н+,
DG0а = -237,531 кДж/моль
Величина стандартного потенциала на аноде:
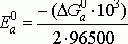 Е0а
= 1,231 В
Е0а
= 1,231 В
Теоретическое напряжение разложения в стандартных условиях
Е0т = Е0а - Е0к Е0т = 1,231 В
По уравнению Гиббса-Гельмгольца:
Ет = -(DН/nF) + Т(¶Е/¶Т)р,
где ¶Е/¶Т - температурный коэффициент, В/град.
Величина (¶Е/¶Т)р вычислена из следующего уравнения, получающегося из уравнения Гиббса-Гельмгольца:
(¶Е/¶Т)р = DS° /(2×96500), В/град
Вычислим DS°к катодной реакции:
Рекомендуем скачать другие рефераты по теме: сообщение об открытии счетов, рефераты на украинском языке.
Категории:
Предыдущая страница реферата | 12 13 14 15 16 17 18 19 20 21 22 | Следующая страница реферата
 Главная
Главная