
Билеты по химии 10 класс
| Категория реферата: Рефераты по науке и технике
| Теги реферата: курсовая работа, тезис
| Добавил(а) на сайт: Катрановский.
Предыдущая страница реферата | 5 6 7 8 9 10 11 12 13 14 15 | Следующая страница реферата
Электролиз растворов и расплавов солей (на примере хлорида натрия). Практическое значение электролиза.
Электролизом называются реакции в растворах или расплавах электролитов, происходящие под действием электрического тока.
В расплавах или растворах происходит диссоциация электролита. Катионы смещаются к катоду, анионы — к аноду.
Электролиз расплавов. На катоде происходит восстановление катионов, на аноде — окисление анионов.
Электролиз расплава хлорида натрия. На катоде восстанавливаются катионы Na+ и выделяется металлический натрий, на аноде окисляются хлорид-ионы и выделяется хлор:
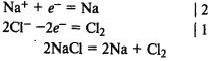
Электролиз водных растворов. В процессах на катоде и аноде могут участвовать не только ионы электролита, но и молекулы воды.
Будут ли на катоде восстанавливаться катионы металла или молекулы воды, зависит от положения металла в ряду напряжений металлов.
![]()
Если металл находится в ряду напряжений правее водорода, на катоде восстанавливаются катионы металла; если металл находится в ряду напряжений левее водорода, на катоде восстанавливаются молекулы воды и выделяется водород. Наконец, в случае катионов металлов от цинка до свинца может происходить либо выделение металла, либо выделение водорода, в зависимости от концентрации раствора и других условий.
На аноде также может происходить либо окисление анионов электролита, либо окисление молекул воды. При электролизе солей бескислородных кислот или самих кислот на аноде окисляются анионы (кроме F–.) В случае кислородсодержащих кислот на аноде окисляются молекулы воды и выделяется кислород.
Электролиз раствора хлорида натрия. На катоде восстанавливаются молекулы воды и выделяется водород, а на аноде окисляются хлорид-ионы и выделяется хлор:
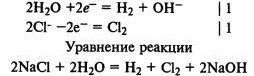
Электролиз раствора нитрата серебра. На катоде восстанавливаются катионы Ag+ и выделяется серебро, на аноде окисляются молекулы воды и выделяется кислород:
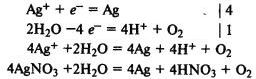
Применение. Электролиз расплавов используют для получения фтора, активных металлов (натрий, калий, магний, кальций, алюминий). Электролиз растворов используют для получения хлора, щелочей, очистки металлов (электрорафинирование).
Билет №12 (углубленно).Электролиз растворов и расплавов солей (на примере хлорида натрия). Практическое значение электролиза.
Совокупность химических реакций, которые протекают на электродах в растворах или расплавах при пропускании через них электрического тока, называется электролизом.
Указанную совокупность реакций принято подразделять на первичные и вторичные процессы. Первичные процессы — окислительно-восстановительные реакции, протекающие на электродах и ведущие, как правило, к образованию электрически нейтральных активных молекулярных или атомных частиц. Вторичные процессы — реакции взаимодействия активных частиц, образовавшихся в первичных процессах, со средой. Например, при электролизе раствора сульфата натрия протекают следующие электродные реакции:
Первичные реакции
![]()
Вторичные реакции
![]()
Приведенная совокупность химических реакций может быть представлена суммарным процессом:
Рекомендуем скачать другие рефераты по теме: капитанская дочка сочинение, вид курсовой работы.
Категории:
Предыдущая страница реферата | 5 6 7 8 9 10 11 12 13 14 15 | Следующая страница реферата
 Главная
Главная