
Билеты по химии 10 класс
| Категория реферата: Рефераты по науке и технике
| Теги реферата: выборы реферат, решебник по математике 6 виленкин
| Добавил(а) на сайт: Gershel'man.
Предыдущая страница реферата | 7 8 9 10 11 12 13 14 15 16 17 | Следующая страница реферата
Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na2O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов:
![]()
Молекулярные оксиды р-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам наглядно проявляется у оксидов элементов 3-го периода.
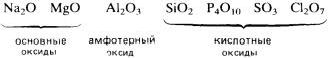
Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
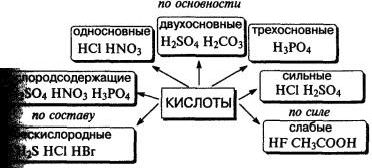
Кислота — сложное вещество, при диссоциации которого образуется только один тип катионов — ионы водорода.
![]()
Классификация кислот.
Соляная кислота — водный раствор газа хлоро-водорода в воде.
Химические свойства. Кислоты изменяют цвет индикаторов: лакмус окрашивается в красный цвет, метилоранж — в желтый.
При реакции с основаниями образуется соль и вода (реакция нейтрализации). В реакцию вступают как растворимые, так и нерастворимые в воде основания:
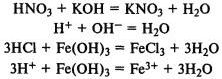
При реакции с основными оксидами образуются со ли:
![]()
Кислоты реагируют с металлами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль:
![]()
Сильные кислоты реагирует с солями слабых кислот, вытесняя слабые кислоты из их солей:
![]()
Получение кислот. Многие кислоты можно получить при реакции кислотных оксидов с водой:
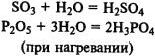
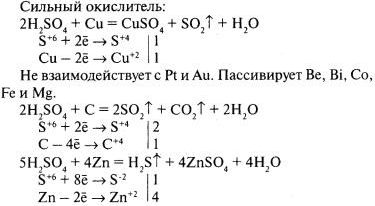
Концентрированная серная кислота при обычной температуре не действует на многие металлы. По этой причине, например, безводная серная кислота в отличие от её растворов может сохраняться в железной таре.
Рекомендуем скачать другие рефераты по теме: шпаргалки по педагогике, доклад по обж.
Категории:
Предыдущая страница реферата | 7 8 9 10 11 12 13 14 15 16 17 | Следующая страница реферата
 Главная
Главная