
Билеты по химии 10 класс
| Категория реферата: Рефераты по науке и технике
| Теги реферата: выборы реферат, решебник по математике 6 виленкин
| Добавил(а) на сайт: Gershel'man.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 11 | Следующая страница реферата
3. Диссоциация – обратимый процесс
В молекуле воды связь ковалентная полярная, молекула угловая, следовательно, молекула воды — диполь.
Причина диссоциации веществ с ионной связью: диполи воды разрушают кристаллическую решетку. 
Причина диссоциации веществ с ковалентной полярной связью: молекулы воды вызывают еще большую поляризацию связи вплоть до ее разрыва.
![]()
Степень диссоциации. Сильные и слабые электролиты
Степень диссоциации — отношение числа распавшихся молекул к общему числу молекул растворенного вещества:
![]()
Если а ® 1, то электролит сильный. В растворе практически нет молекул. Примеры: НСl; NaOH; KBr.
Если а ® 0, то электролит слабый. В растворе много молекул и мало ионов. Примеры: H2S; NH3; Fe(SCN)3.
Диссоциация кислот, щелочей и солейКислоты — электролиты, в растворах которых нет других катионов, кроме катионов водорода.
Многоосновные кислоты диссоциируют ступенчато:
![]()
![]()
Основания — электролиты, в растворах которых нет других анионов, кроме гидроксид-ионов.
![]()
![]()
Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
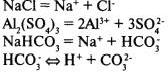

Электролиты и неэлектролиты. Электролическая диссоциация неорганических кислот, солей, щелочей. Степень диссоциации.
Электролит проводит электрический ток в результате того, что направленное перемещение его ионов создает поток электрических зарядов. Таким образом, пропускание электрического тока через электролит сопровождается переносом вещества.
Электролитами чаще всего являются такие соединения, как кислоты, основания или соли, находящиеся в расплавленном состоянии или в водных растворах. Способность электролитов проводить электрический ток называется электролитической проводимостью. Ее следует отличать от электронной проводимости обычных проводников электрического тока, например металлов. В веществах с электронной проводимостью поток заряда обусловлен потоком электронов, а не перемещением ионов. Поэтому пропускание электрического тока через проводники с электронной проводимостью не сопровождается переносом вещества.
Электролиты в свою очередь могут быть подразделены на два типа: сильные и слабые электролиты. Сильный электролит – это соединение, которое в расплавленном состоянии или в растворе полностью ионизировано. Примером сильного электролита может служить соляная кислота. При растворении хлороводорода в воде происходит его полная ионизация:
![]()
Рекомендуем скачать другие рефераты по теме: шпаргалки по педагогике, доклад по обж.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 10 11 | Следующая страница реферата
 Главная
Главная