
Электрохимические методы защиты металлов от коррозии
| Категория реферата: Рефераты по науке и технике
| Теги реферата: биология 6 класс, конспект
| Добавил(а) на сайт: Jakimov.
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата
Следовательно, термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин «окисление», независимо от того вредно или полезно оно для нашей практики.
Коррозия является естественным процессом, обусловленным термодинамической нестойкостью металлов в условиях службы. Естественно поэтому, что изучение коррозии и разработка методов защиты металлов от нее представляют несомненный теоретический интерес и имеют большое народнохозяйственное значение.
Химическое и электрохимическое окисление металлов.Кинетика процессов окисления зависит от природы среды, содержащий окислитель. Если среда представляет собой электролит (очень частый случай), окисление протекает по электрохимическому механизму:
Me à Mez+ + ze (1)
n ox + ze àm red (2)
где ox-окислитель, а red- восстановленная форма его.
Реакции (1) и (2) протекают сопряженно на анодных и катодных участках, площадью ![]() и
и ![]() ,соответственно, но подчиняясь каждая своим кинетическим
закономерностям. Необходимо только соблюдение условия стационарности процесса, т. е. равенства скоростей окисления металла и восстановления. Из условия
стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
,соответственно, но подчиняясь каждая своим кинетическим
закономерностям. Необходимо только соблюдение условия стационарности процесса, т. е. равенства скоростей окисления металла и восстановления. Из условия
стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Если окислитель не является электролитом, то обмен электронами совершается непосредственно между металлом и окислителем:
m Me + n ox à Mem(red)n
Здесь окисление протекает по химическому механизму.
Таким образом, принято различать электрохимическую и химическую коррозию, хотя такое разделение в некоторой степени условно.
Общие положения электрохимической теории коррозии.Рассмотрим схему коррозионного процесса. Сложность его заключается в том, что на одной и той же поверхности происходят одновременно два процесса, противоположные по своему химическому смыслу: окисление металла и восстановление окислителя. Оба процесса должны протекать сопряженно, чтобы сохранялось равенство числа электронов, отдаваемых металлом и присоединяющихся к окислителю в единицу времени. Только в этом случае может наступить стационарное состояние.
Электрохимический механизм протекания процесса предполагает, что окисление и восстановление подчиняются свойственным им зависимостям между потенциалом и током, где ток выражает скорость процесса. Кинетика коррозии определяется кинетикой окисления металла и восстановления окислителя. Необязательно, чтобы эти два процесса происходили на одной точке поверхности металла. Электрон, освобожденный металлом в одной точке, может переместиться в соседнюю и там присоединиться к окислителю. Перемещение электрона в пределах металла на малые расстояния происходит практически беспрепятственно, вследствие высокой электронной проводимости. Точки, где осуществляются элементарные акты окисления и восстановления, могут мигрировать на поверхности металла, меняться местами и т. д. ,подчиняясь законам случайности. Под влиянием различных причин они могут быть фиксированы на поверхности, вызывая местную коррозию. Это особенно свойственно полифазным сплавам.
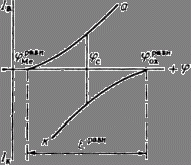
Рис. 1. Простейшая коррозионная диаграмма: а – анодная кривая; к – катодная кривая; ![]() ,
, ![]() - равновесные
потенциалы металла и окислителя;
- равновесные
потенциалы металла и окислителя; ![]() - стационарный
потенциал корродирующего металла.
- стационарный
потенциал корродирующего металла.
Независимое, но сопряженное протекание процессов окисления и восстановления позволяет рассматривать коррозию при помощи анодных
и катодных поляризационных кривых. На рис.1 показана коррозионная диаграмма для металла и окислителя. Чтобы окисление металла окислителем могло иметь место, ![]() должен быть отрицательнее, чем
должен быть отрицательнее, чем ![]() . Попробуем отделить пространственно металл от окислителя, построив, например, гальванический элемент вида:
. Попробуем отделить пространственно металл от окислителя, построив, например, гальванический элемент вида:
![]() ,
,
где Me-активный металл, который может окисляться; ox и red-окисленная и восстановленная форма окислителя; Me /-некоторый “гипотетический” инертный металл, который не может окисляться данным окислителем, но на котором кинетика процесса ox à red такова же, как на активном металле Me.
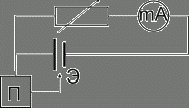
Рис. 2. Схема электрической цепи с регулируемым сопротивлением , используемой для получения данных для построения поляризационной диаграммы. Где Э – электрод сравнения, mА – миллиамперметр, П – потенциометр.
Для получения коррозионной диаграммы необходимо построить электрическую цепь, изображённую на
рисунке 2. Проведя несколько измерений, изменяя величину сопротивления, и соответственно наблюдая за изменением силы тока, а также потенциала в цепи, строят зависимость ![]() . График подобной зависимости изображён на рисунке 1.
. График подобной зависимости изображён на рисунке 1.
При разомкнутой цепи мы измерили бы э.д.с. ![]() , являющуюся мерой максимальной работы процесса окисления
металла
, являющуюся мерой максимальной работы процесса окисления
металла ![]() . Как известно,
. Как известно, ![]() , где
, где ![]() – количество электричества, связанное с реакцией на
электродах и числом молей компонентов равных стехиометрическим коэффициентам. При этом сила тока
– количество электричества, связанное с реакцией на
электродах и числом молей компонентов равных стехиометрическим коэффициентам. При этом сила тока ![]() (или ничтожна мала), так что обеспечено обратимое протекание процесса, т.е. совершение максимальной работы
(или ничтожна мала), так что обеспечено обратимое протекание процесса, т.е. совершение максимальной работы ![]() . Причиной протекания реакций окисления металла и восстановления окислителя является изменение термодинамического потенциала, или
свободной энтальпии[2]. В этом отношении
. Причиной протекания реакций окисления металла и восстановления окислителя является изменение термодинамического потенциала, или
свободной энтальпии[2]. В этом отношении ![]() имеет большое значение, определяя термодинамическую возможность коррозии.
имеет большое значение, определяя термодинамическую возможность коррозии.
Если не пользоваться гальваническим элементом, а просто погрузить металл в раствор, содержащий окислитель, то стационарное состояние будет возможно только в том случае, если скорость реакции окисления металла (1) будет равна скорости восстановления окислителя (2).
Это означает, что при стационарном потенциале ![]() скорость анодного процесса (окисления) равна скорости катодного процесса (восстановления). Равенство скоростей реакций (1) и (2)
выражено на рис.1 равенством ординат (сил тока), отвечающих
скорость анодного процесса (окисления) равна скорости катодного процесса (восстановления). Равенство скоростей реакций (1) и (2)
выражено на рис.1 равенством ординат (сил тока), отвечающих ![]() . Необходимо подчеркнуть, что в этом случае нет
электрического тока, доступного непосредственному измерению. Слово «ток» означает, что число частиц (или грамм-частиц), прореагировавших на поверхности
металла, можно выразить в единицах силы тока. Если площадь поверхности электрода
. Необходимо подчеркнуть, что в этом случае нет
электрического тока, доступного непосредственному измерению. Слово «ток» означает, что число частиц (или грамм-частиц), прореагировавших на поверхности
металла, можно выразить в единицах силы тока. Если площадь поверхности электрода ![]() , то
, то ![]() и
и ![]() , где
, где ![]() и
и ![]() - плотности анодного и катодного токов, соответственно. Для рассматриваемого случая условие
стационарности можно выразить через
- плотности анодного и катодного токов, соответственно. Для рассматриваемого случая условие
стационарности можно выразить через ![]() или через
или через ![]() , если принять, что обе реакции протекают на поверхности одной и той же величины
, если принять, что обе реакции протекают на поверхности одной и той же величины ![]() .
.
На рис.1 изображены анодная а и катодная к поляризационные кривые для
данного металла в растворе определенного состава и для данного окислителя на поверхности того же металла. Наклон кривых а и к определяет
кинетику процесса. Таким образом, рисунок содержит сведения о термодинамической возможности коррозии данного металла некоторым окислителем и о скорости этого
процесса, определяемой кинетикой реакций (1) и (2), т.е. зависимостью их скоростей от смещения соответствующих потенциалов от равновесного значения.
Коррозия возможна только в том случае, если ![]() . Если
. Если ![]() и
и ![]() или
или ![]() , то окисление металла невозможно (рис.2 ).
, то окисление металла невозможно (рис.2 ).
Рекомендуем скачать другие рефераты по теме: доклади, готовые рефераты.
Категории:
Предыдущая страница реферата | 1 2 3 4 | Следующая страница реферата
 Главная
Главная