
Ионометрическое определение хлоридов в растворах хроматов
| Категория реферата: Рефераты по науке и технике
| Теги реферата: изложение русский язык 6 класс, сочинение рассказ
| Добавил(а) на сайт: Степнов.
1
Ионометрическое определение хлоридов в растворах хроматов
Немировский А.М.
Задача определения хлоридов в хроматных растворах пришла от гальваников. Дело в том, что в травильных ваннах необходимо было контролировать содержание хлоридов. Зачем это нужно я не знаю до сих пор, но задачу контроля хлоридов я решил.
Состав раствора ванны был совершенно убийственен: 400 г/л CrO3. В этом растворе следовало определять хлорид с концентрацией более 10-3M.
Делая ставку на хлоридселективный электрод ЭМ-Сl-01, я начал экспериментальную работу. Сначала я разбавил анализируемый раствор в 10 раз для того, чтобы снизить агрессивность среды. В итоге pH среды примерно стал равен 1 при содержании CrO3 = 40 г/л. Затем предо мной встал вопрос о нейтрализации кислотной среды пробы. Дальнейшие исследования показали, что нейтрализация ухудшает условия определения хлорида, делая дальнейший анализ невозможным. Почему?
Дело в том, что в кислой среде CrO3 преимущественно существует в виде Cr2O72-. По мере увеличения pH, преимущество получает форма CrO42-. С другой стороны селективность хлоридного электрода к тому или иному аниону определяется растворимостью соединения этого аниона с катионом серебра. (Хлоридселективный электрод представляет собой пресованную таблетку, состоящую из смеси хлорида и сульфида серебра.) Поскольку растворимость Ag2CrO4 очевидно меньше растворимости Ag2Cr2O7, то это означает, что хлоридселективный электрод будет обладать большей чувствительностью к ионам CrO42-. Таким образом, напрашивается вывод о том, что стремиться к нейтрализации раствора пробы не нужно.
Калибровка электрода в растворах CrO3 дала следующие результаты.
Во-первых, перед анализом в начале рабочего дня электрод нужно было подготовить к работе, опустив его на час в раствор CrO3. Если этого не делать, потенциал электрода испытывает существенный дрейф.
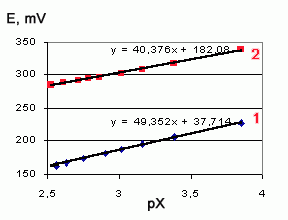
Во-вторых, калибровка по хлориду линейна по крайней мере в области концентраций pX=4-2,5, хотя наклон несколько отличается от теоретического (см. рисунок).
|
|
В-третьих, оказалось, что пользоваться для анализа методом градуировочного графика нельзя, так как небольшие изменения в составе пробы вызывают существенное изменение потенциала (см. рисунок). Пользоваться можно только методом добавок, поскольку наклон калибровок меняется не столь существенно. Расчеты показывают, что уменьшение концентрации CrO3 от 40 г/л до 20 г/л вызывает ошибку в 20 % при анализе методом добавок.
В заключении следует сказать о том, что измерения в такой агрессивной среде, какую создают хроматы, существенно сокращают срок службы электрода. В связи с этим хранить электрод рекомендуется в сухом состоянии, а не оставлять в анализируемом растворе.
Скачали данный реферат: Яновицкий, German, Аглая, Смолин, Софрон, Сабанцев.
Последние просмотренные рефераты на тему: 7 ответов, отечественная война реферат, сочинение капитанская, конфликт реферат.
Категории:
1
 Главная
Главная