
Каталитический этюд
| Категория реферата: Рефераты по науке и технике
| Теги реферата: как сделать шпаргалку, энергия реферат
| Добавил(а) на сайт: Garanin.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
В ходе изучения процесса мы выяснили, что так же, как в рассмотренной только что изомеризации, увеличение количества катализатора не дает существенного выигрыша в конверсии. Чтобы детальнее исследовать это явление, мы оценили активность катализатора как конверсию, приходящуюся на один моль меди [6]. Оказалось, что максимальной активность бывает при весьма низком содержании каталитических центров на носителе - до 0.1%. Это нельзя было объяснить тем, что часть их находится в глубинных слоях катализатора и потому не участвует в катализе. Причины обнаружились при изучении особенностей строения самого катализатора.
В двух упомянутых катализаторах - комплексе галогенида меди и медьсодержащем фенилсилоксане - координационные сферы иона меди (т.е. атомы, окружающие Cu) различаются. Следовательно, сравнив работу этих катализаторов в обменном галогенировании, можно выяснить некоторые детали каталитического механизма.
A priori возможны три варианта:
- радикально-цепной механизм (с участием ионов меди переменной валентности);
- окислительное присоединение CCl4 к металлическому центру, протекающее в координационной сфере металла;
- стабилизация радикала ·CCl3 в координационной сфере металла.
Чтобы понять, какой именно вариант действует, мы исследовали поведение двух этих катализаторов при совместном хлорировании трех пар углеводородов [5]:
|
декан–гексан |
декан–толуол |
гексан–толуол |
|
С10Н22 – С6Н12 |
С10Н22– С6Н5СН3 |
С6Н12–С6Н5СН3 |
Два результата косвенно указывали на то, что реализуется радикально-цепной механизм: в толуоле хлорированию подвергалась преимущественно метильная группа; при хлорировании декана практически не затрагивались концевые группы СН3. Все это характерно для реакций отрыва атома водорода радикалом ·CCl3.
Мы рассудили, что если справедлива радикально-цепная схема, то при конкурирующем хлорировании двух углеводородов соотношение продуктов реакции должно соответствовать известным из литературы данным об активности атомов водорода при атаке связей С–Н радикалом ·CCl3. Кроме того, относительная реакционная способность не должна зависеть от типа комплекса, содержащего медь.
Если же процесс протекает в координационной сфере металла (как во втором и третьем вариантах), то особенность строения катализатора должна сказываться заметно, а соотношение продуктов должно отличаться от обычного соотношения активностей реакционных центров при атаке ·CCl3.
Результаты совместного хлорирования указанных трех пар углеводородов и поочередного использования двух катализаторов показали, что процесс протекает по радикально-цепному механизму. Действительно, соотношение продуктов хлорирования соответствовало взятым из литературы соотношениям реакционной способности атомов водорода при их отрыве радикалом ·CCl3 и практически не зависело от типа катализатора.
Обменное галогенирование мы изучили, используя еще один галогенирующий агент - CBr4 [7]. В итоге удалось выработать общую схему процесса (рис.4). Она состоит из двух равноправных ветвей. Первая - это превращение каталитического центра: согласно классической схеме, катализатор после участия в реакции возвращается в исходное состояние. Вторая ветвь - передача радикального центра по цепочке: от радикала ·CHal3 к углеводороду, затем вновь к CHal4 и т.д., в полном соответствии с определением радикально-цепных реакций.
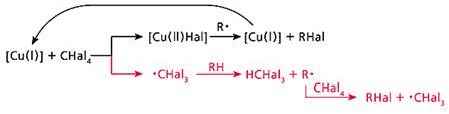
Рис. 4. Общая схема обменного галогенирования.
Верхняя ветвь - превращение каталитического центра, нижняя - радикально-цепной процесс.
В предложенной схеме есть одна деталь, которая требует пояснения. В медьсодержащем силоксановом катализаторе атом меди находится в состоянии Cu(II), а на схеме процесс начинается с Cu(I). Причину несоответствия удалось найти с помощью процедуры, которая позволяет обнаружить атомы меди, находящиеся в разной степени окисления. Исходные и выдержанные при 150°С (стадия, завершающая подготовку катализатора к дальнейшему его использованию) катализаторы мы обработали азотсодержащими лигандами и проанализировали их УФ-спектры [8]. Оказалось, что незначительная часть атомов меди при термообработке частично восстанавливается, и этого вполне достаточно, чтобы началась радикально-цепная реакция. Далее новые каталитические центры Сu(I) образуются благодаря возникающим в реакционной системе свободным радикалам.
Предотвратить координацию
В процессе обменного галогенирования хлор присоединяется к любому из вторичных атомов углерода в декане, не затрагиваются лишь концевые СН3-группы. В результате образуется смесь монохлордеканов. Такая скромная селективность обычно не удовлетворяет химиков; частично ее можно усилить заменив ненасыщенный углеводород насыщенным в качестве исходного реагента. Если вместо алкана взять алкен, положение двойной связи само укажет то место, куда должен присоединиться Cl, а также фрагмент CCl3 (рис.5).

Рис. 5. Каталитическое присоединение CCl4 к олефину.
Рекомендуем скачать другие рефераты по теме: реферат по обже, сообщения в одноклассниках.
Категории:
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
 Главная
Главная