
Кинетика мономолекулярных реакций в плотных средах
| Категория реферата: Рефераты по науке и технике
| Теги реферата: реферат вода, предмет культурологии
| Добавил(а) на сайт: Адриан.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
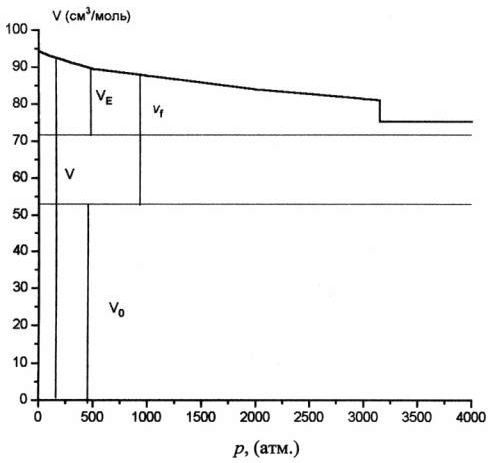
При р=1 атм. vf= 41 см3/моль, a VE =18,4 см3/моль. При р=3125 атм. чистый бензол затвердевает со скачкообразным уменьшением объема на DVs,l =5,7 см3/моль [15]. Эта величина составляет при р = 1 атм. 6% от V(1), 14% от vfи 32% от VE.
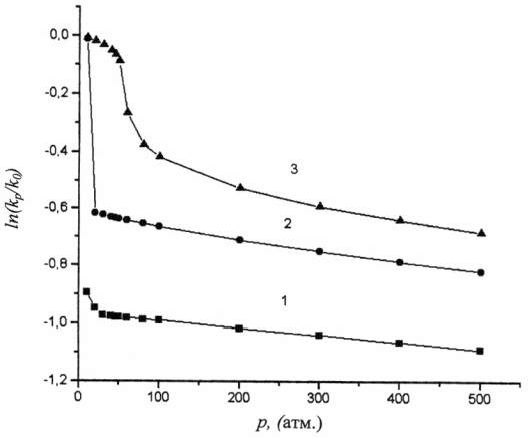 Из рис.3 видно, что зависимость
Из рис.3 видно, что зависимость![]() от p, построенная с использованием VE, намного круче, чем для кривой, построенной с использованием vf. Объем активации
от p, построенная с использованием VE, намного круче, чем для кривой, построенной с использованием vf. Объем активации![]() , вычисленный по уравнению (1), равен 30,3 см3/моль для первой кривой
и только 7,2 см3/моль для второй кривой. Особенно различно их
поведение в области затвердевания бензола. Если у второй кривой величина скачка
, вычисленный по уравнению (1), равен 30,3 см3/моль для первой кривой
и только 7,2 см3/моль для второй кривой. Особенно различно их
поведение в области затвердевания бензола. Если у второй кривой величина скачка![]() незначительна
и лежит в пределах точности кинетических экспериментов, то на первой кривой
величина торможения при переходе от жидкого состояния к твердому, так
называемый ТЭР = 665. Это чрезвычайно высокое значение. Согласно [15], такой
ТЭР могут иметь вещества с температурой плавления tm порядка 2000С.
Для бензола, имеющего при атмосферном давлении tm= 5,5530С
[14], ТЭР должен быть порядка 1. Более того, в экспериментах над реакциями в
растворах не наблюдались скачки скорости при затвердевании растворителя под
действием давления, хотя следует заметить, что специально такие эксперименты не
ставились. В настоящий момент представляется, что использование vf в
уравнении (2) более обосновано, чем использование VE.
незначительна
и лежит в пределах точности кинетических экспериментов, то на первой кривой
величина торможения при переходе от жидкого состояния к твердому, так
называемый ТЭР = 665. Это чрезвычайно высокое значение. Согласно [15], такой
ТЭР могут иметь вещества с температурой плавления tm порядка 2000С.
Для бензола, имеющего при атмосферном давлении tm= 5,5530С
[14], ТЭР должен быть порядка 1. Более того, в экспериментах над реакциями в
растворах не наблюдались скачки скорости при затвердевании растворителя под
действием давления, хотя следует заметить, что специально такие эксперименты не
ставились. В настоящий момент представляется, что использование vf в
уравнении (2) более обосновано, чем использование VE.
Для сравнения
результатов, полученных по уравнению (1) и (2) обозначим объем активации в
уравнении (1) как![]() , а в
уравнении (2) как
, а в
уравнении (2) как![]() . Эти объемы
активации при р®1атм. относятся как
. Эти объемы
активации при р®1атм. относятся как
![]() ,
,
где V(0) и![]() –
соответственно, мольный объем и сжимаемость при р®1атм. Величина
–
соответственно, мольный объем и сжимаемость при р®1атм. Величина![]() может быть
рассчитана, например, по методу Рао [16,17], групповые инкременты, необходимые
для этих расчетов, содержатся в [18]. Таким образом, расчеты по теории
Эванса-Поляни дают для объемов активации в растворах величины, в 2 ? 6 раз
меньшие, чем дает теория свободного объема.
может быть
рассчитана, например, по методу Рао [16,17], групповые инкременты, необходимые
для этих расчетов, содержатся в [18]. Таким образом, расчеты по теории
Эванса-Поляни дают для объемов активации в растворах величины, в 2 ? 6 раз
меньшие, чем дает теория свободного объема.
В настоящее
время отсутствуют надежные экспериментальные данные по величинам![]() начальных, мономолекулярных стадий реакций в твердых органических веществах в широком
интервале давлений, достаточном для определения влияния давления на константу
скорости начальной, мономолекулярной стадии реакции. В экспериментах по влиянию
высокого давления на процессы теплового воспламенения или на зажигание ВВ
исследуются глубокие, автокаталитические стадии химического процесса, и потому
вычисленные в этих работах
начальных, мономолекулярных стадий реакций в твердых органических веществах в широком
интервале давлений, достаточном для определения влияния давления на константу
скорости начальной, мономолекулярной стадии реакции. В экспериментах по влиянию
высокого давления на процессы теплового воспламенения или на зажигание ВВ
исследуются глубокие, автокаталитические стадии химического процесса, и потому
вычисленные в этих работах![]() не
относятся к начальным, мономолекулярным стадиям. Однако существует интересное
явление, состоящее в резком снижении скорости мономолекулярных реакций в
органических веществах при переходе от жидкого состояния к твердому [3,19-21].
Для ряда веществ ТЭР может превосходить 10000. Известно, что при переходе
вещества из одной кристаллической модификации в другую скорость химической
реакции в нем изменяется. Эти явления могут быть описаны в рамках предлагаемой
модели.
не
относятся к начальным, мономолекулярным стадиям. Однако существует интересное
явление, состоящее в резком снижении скорости мономолекулярных реакций в
органических веществах при переходе от жидкого состояния к твердому [3,19-21].
Для ряда веществ ТЭР может превосходить 10000. Известно, что при переходе
вещества из одной кристаллической модификации в другую скорость химической
реакции в нем изменяется. Эти явления могут быть описаны в рамках предлагаемой
модели.
При переходе от
жидкого состояния к твердому, объем вещества уменьшается примерно на 10% [22].
Это приводит к уменьшению свободного объема и, соответственно, скорости
реакции. Величина тормозящего эффекта решетки (ТЭР =![]() для разных
веществ лежит в широком интервале от единиц до 104 [17]. Следует
учитывать, что при ТЭР >103 реакция локализуется на неравновесных
дефектах, дислокациях, границах зерен, поверхности, примесях, и потому истинный
ТЭР может быть значительно выше.
для разных
веществ лежит в широком интервале от единиц до 104 [17]. Следует
учитывать, что при ТЭР >103 реакция локализуется на неравновесных
дефектах, дислокациях, границах зерен, поверхности, примесях, и потому истинный
ТЭР может быть значительно выше.
Для
кристаллических веществ данное выше определение vf нуждается в
уточнении. В рамках ячеечной модели Ленард-Джонса [23] свободный объем может
быть рассчитан методом атом-атом потенциала [24]. Величину VEможно
оценить по тепловому расширению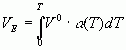 , где V0-
мольный объем при 0 К, a (Т) - термический коэффициент расширения. Если a =
const, то при V0 = 100 см3/моль и Т = 500 K VE
равен 5 см3/моль при a= 10-4град-1 и 50 см3/моль
при a= 10-3 град-1. Энергоемкие соединения, состоящие из
полярных молекул, имеют a= (1 - 2,5).10-4 град-1, величина a» 10-3 град-1 характерны для парафинов [25]. В
органических кристаллах от 20 до 36% вещества приходится на пустоты упаковки
[25], т.е. на VV. Этот объем не является абсолютно недоступным.
По-видимому, при удачном расположении реакционного центра относительно пустот
упаковки, они могут быть использованы для создания Vc [21].
, где V0-
мольный объем при 0 К, a (Т) - термический коэффициент расширения. Если a =
const, то при V0 = 100 см3/моль и Т = 500 K VE
равен 5 см3/моль при a= 10-4град-1 и 50 см3/моль
при a= 10-3 град-1. Энергоемкие соединения, состоящие из
полярных молекул, имеют a= (1 - 2,5).10-4 град-1, величина a» 10-3 град-1 характерны для парафинов [25]. В
органических кристаллах от 20 до 36% вещества приходится на пустоты упаковки
[25], т.е. на VV. Этот объем не является абсолютно недоступным.
По-видимому, при удачном расположении реакционного центра относительно пустот
упаковки, они могут быть использованы для создания Vc [21].
Объем активации
в кристалле зависит от локального молекулярного окружения и может значительно
отличаться от DV?, определенного в растворе, то есть Vc =![]() = g
= g![]() . Появление
g > 1 можно пояснить на простом примере. Пусть молекула имеет форму шара и Vo
=4/3pR3 , а объем активации в виде полусферы с радиусом
. Появление
g > 1 можно пояснить на простом примере. Пусть молекула имеет форму шара и Vo
=4/3pR3 , а объем активации в виде полусферы с радиусом![]()
![]()
![]() r?, равный
r?, равный![]() = 2/3 p ( r?
)3, расположен в точке касания молекул. Тогда
= 2/3 p ( r?
)3, расположен в точке касания молекул. Тогда![]() будет иметь
форму цилиндра с радиусом R и высотой r? и g= 3/2(V0/2?
будет иметь
форму цилиндра с радиусом R и высотой r? и g= 3/2(V0/2?![]() )2/3.
Для DV?= 1; 5 и 10 см3/моль значения
)2/3.
Для DV?= 1; 5 и 10 см3/моль значения![]() и g будут
соответственно 33,6; 57,5 и 72,5 см3/моль и 33,6; 11,5; 7,25. В
случае, если реакционный центр расположен так, что для образования АК могут
быть использованы пустоты упаковки, то g может быть меньше 1. Примером такого
соединения может служить 1,3-дифенилтриазен [26].
и g будут
соответственно 33,6; 57,5 и 72,5 см3/моль и 33,6; 11,5; 7,25. В
случае, если реакционный центр расположен так, что для образования АК могут
быть использованы пустоты упаковки, то g может быть меньше 1. Примером такого
соединения может служить 1,3-дифенилтриазен [26].
Пока не выяснено, можно ли применять уравнение (2) для кристаллов. Доводом в пользу его применимости может быть то, что аксиомы ячеечной модели более соответствуют кристаллам, а не жидкостям и газам, для которых она была первоначально предложена, и в рамках которой было введено понятие ”свободный объем” [24].
Если
предлагаемая модель справедлива для молекулярных кристаллов, то для веществ, имеющих ТЭР = 104, отношение![]() должно быть
9,2 а для ТЭР = 10
должно быть
9,2 а для ТЭР = 10![]() =2,3.
Несмотря на то, что в рассматриваемой модели свободный объем образует Vс
без затрат или выигрыша энергии, чисто комбинаторно, тем не менее
дополнительная энергия активации
=2,3.
Несмотря на то, что в рассматриваемой модели свободный объем образует Vс
без затрат или выигрыша энергии, чисто комбинаторно, тем не менее
дополнительная энергия активации![]() появляется
из-за температурной зависимости vf.
появляется
из-за температурной зависимости vf.
В [27] было показано, что 1,3,5,7-тетранитро - 1,3,5,7 - тетраазациклооктан в различных полиморфных модификациях имеет различные скорости термораспада. Приняв коэффициент термического расширения для всех трех модификаций равным a= 1,4.10-4 град-1 , получим оценки величин VT и DVs?(см. табл.).
В заключение
рассмотрим влияние высокого давления на реакции с отрицательным объемом
активации. Примером таких реакций могут служить реакции с циклическим АК.
Поскольку характерные времена внутримолекулярных перегруппировок много меньше
времен межмолекулярных движений, то химическая реакция происходит при
неподвижном молекулярном окружении и потому влияние давления реализуется до
начала молекулярной перегруппировки и состоит в упругой деформации молекулы по
координате реакции. В результате энергия основного состояния молекулы
увеличивается на величину, пропорциональную квадрату давления, соответственно
на эту величину уменьшается энергия активации, что приводит к ускорению
химической реакции. Так как молекулярное окружение одновременно тормозит
внутримолекулярные движения по рассмотренному выше механизму, то суммарное
влияние давления можно описать как![]() , где с>
0 - коэффициент, характерный для данной реакции. Так как первый член зависит от
давления почти линейно, то зависимость может быть приближенно представлена в
виде
, где с>
0 - коэффициент, характерный для данной реакции. Так как первый член зависит от
давления почти линейно, то зависимость может быть приближенно представлена в
виде
![]() .
.
Следует заметить, что отсутствие внимания к влиянию на скорость реакции плотности вещества и акцентирование внимания на эффектах давления следует, видимо, из того, что при изменении давления в широком диапазоне от атмосферного до тысяч атмосфер плотность меняется незначительно, на несколько процентов.
Список литературы
1. Evans M.G., Polanyi M.//Trans. Faraday Soc. 1935. V.31. P. 875.
2. Van,t Hoff J.H. Lectures on Theoretical and Physical Chemistry. Braunschweig, 1901.
3. Манелис Г.Б. Некоторые особенности механизма реакций в твердой фазе// Проблемы кинетики элементарных химических реакций. М.: Наука. 1973.С.93.
4. Eckert C.A. Annual Review of Physical Chemistry, H.Eyring - Editor for University of Utah. 1972. V. 23. P. 239.
5. Ландау Л.Д., Лифшиц Е.М. Статистическая физика//Теоретическая физика. Т.5. С.56.
6. Бурштейн А.И. Молекулярная физика. Новосибирск: Наука. Сиб. отд- ние, 1986. C 128.
7. Cohen M.H., Turnbull D.// J. Chem. Phys. 1959 V. 31. P. 1164.
8. Глесстон С., Лейдлер К., Эйринг Г. Теория абсолютных скоростей реакций, ИЛ, М., 1948. [Glasstone S., Laidler K., Eyring H. The Theory of Rate Processes. NY and London. Frick Chemical Laboratory. Princeton University. 1941].
9. Asped J.// J. Am. Chem. Soc. 1969. V.91. P. 7580.
Рекомендуем скачать другие рефераты по теме: оформление доклада, курсовая работа производство.
Категории:
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
 Главная
Главная