
Молекулярная физика
| Категория реферата: Рефераты по науке и технике
| Теги реферата: страхование реферат, сообщение об открытии
| Добавил(а) на сайт: Venedikta.
Предыдущая страница реферата | 1 2 3 4 5 6 7 | Следующая страница реферата
Квадратный корень из этой величины называется средней квадратичной скоростью: 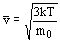
Опыты по определению скоростей молекул доказали справедливость этой формулы. Одни из опытов был предложен О.Штерном в 1920 году.
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). Универсальная газовая постоянная:На основе зависимости давления газа от концентрации его молекул и температуры можно получить уравнение, связывающее все три макроскопических параметра: давление, объем и температуру- характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа.
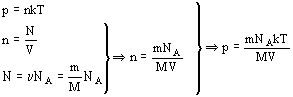
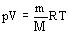 , где
, где 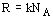 - универсальная газовая постоянная
- универсальная газовая постоянная
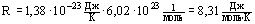
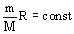 для данной массы газа, следовательно
для данной массы газа, следовательно
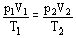 - уравнение Клапейрона.
- уравнение Клапейрона.
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами. А процессы, протекающие при неизменном значении одного из параметров,- изопроцессами.
Изотермический процесс – процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре.
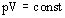 при
при 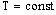
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. – закон Бойля- Мариотта.
Изохорный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме.
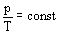 при
при 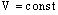
Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется. – закон Шарля.
Изобарный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
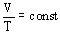 при
при 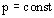
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется. – закон Гей-Люссака.
Внутренняя энергия:Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) относительно центров масс тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
При любых процессах в изолированной термодинамической системе внутренняя энергия остается неизменной. 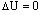
Для вычисления внутренней энергии идеального одноатомного газа массой 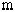 нужно умножить среднюю кинетическую энергию одного атома
нужно умножить среднюю кинетическую энергию одного атома 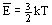 на число атомов
на число атомов 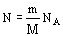 . Учитывая, что
. Учитывая, что 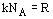 , получим значение внутренней энергии идеального газа:
, получим значение внутренней энергии идеального газа:
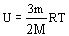
Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия равна сумме поступательного и вращательного движения молекул.
Для двухатомного газа: 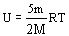
Для многоатомного газа: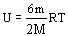
Рекомендуем скачать другие рефераты по теме: пожары реферат, ответы 5 класс.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 7 | Следующая страница реферата
 Главная
Главная