
Начала кондуктометрии
| Категория реферата: Рефераты по науке и технике
| Теги реферата: конституционное право шпаргалки, скачать шпаргалки по истории
| Добавил(а) на сайт: Якущенко.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
OH- 0,0174 0,01976
Интересно сделать расчет самой малой концентрации, которую позволяют определять кондуктометры с ценой деления 0,1 мкСм/см. Оказывается, что для большинства солей пределом обнаружения служит величина 8 10-7н. Для кислот предел обнаружения равен 2 10-7н.
4. Температура анализируемого раствора оказывает существенное влияние на измеряемые величины удельной электропроводности. В настоящее время не существует способа удовлетворительного описания влияния температуры на электропроводность. Причина такого положения дел кроется в слишком большом влиянии индивидуальной природы растворенных веществ на температурный коэффициент. С уверенностью можно сказать только одно: при повышении температуры на один градус удельная электропроводность раствора в среднем увеличивается на 1-2,5%.
Прямые кондуктометрические измерения.
Аналитическое использование кондуктометрии обладает характерными чертами, связанными с низкой селективностью кондуктометрического детектирования. В самом деле, близкие значения эквивалентных электропроводностей ионов не позволяют говорить о том, что какой-либо ион может целиком определять электропроводность всего раствора. Таким образом, измерения электропроводности может приносить реальную аналитическую пользу только в том случае, если соотношение ионов в анализируемой смеси неизменно от пробы к пробе. Это, так называемая, задача определения разбавления исходного раствора. Примерами могут служить анализ промывных вод в ваннах отмывки гальванического производства, контроль за приготовлением технологических растворов в производственных условиях и т.п.
Кондуктометрическое титрование.
Несомненно, большими аналитическими возможностями обладает кондуктометрическое титрование. Титрование позволяет восполнить недостаток селективности определения применением селективного к анализируемому иону титранта. Известны примеры кислотно-основного, осадительного, комплексонометрического титрований. Точность кондуктометрического титрования составляет 1%, но если принять меры по термостатированию анализируемого раствора, то точность определения можно в несколько раз увеличить.
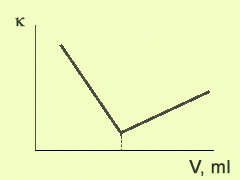
Типичный вид кривой кондуктометрического титрования представлен на рисунке 1.
|
|
|
Рис. 1. |
Точка эквивалентности на графике находится пересечением двух прямых. Одна прямая (до точки эквивалентности) отражает изменение концентрации анализируемого иона и ионов титранта, а другая (после точки эквивалентности) является следствием увеличения концентрации ионов титранта.
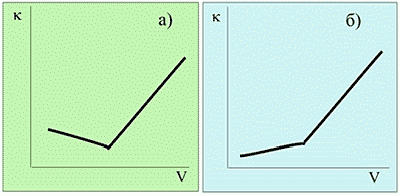
Однако не всегда кривая титрования имеет такой вид. На рис.2 приведены в качестве примера кривые титрования, полученные в результате различных аналитических определений.
|
|
|
Рис. 2. |
Вид кривых очевидно различен. В связи с этим возникает закономерный вопрос о причинах различий и возможности прогнозирования вида кривой на основании данных о свойствах анализируемого иона и вещества титранта. В большинстве случаев прогноз возможен, поскольку вид кривой титрования определяется разностью эквивалентных электропроводностей анализируемого иона и ионов, составляющих вещество титранта.
Рассмотрим несложный расчет, позволяющий прогнозировать вид кривой титрования. Прежде всего, нужно ясно представить себе перечень ионов, принимающих участие в процессе титрования. Пусть нам предстоит определить хлорид с помощью осадительной реакции с нитратом серебра (рис. 2а):
Cl- + Ag+ + NO3- = AgCl + NO3-.
Не вызывает сомнения, что в процессе титрования до точки эквивалентности происходит уменьшение ионов Cl- и NO3-. Увеличение концентрации ионов Ag+ практически не происходит, так как серебро осаждается ионом Cl-. В связи с этим можно утверждать, что динамика электропроводности происходит со скоростью, пропорциональной сумме
-l 0Cl + l 0NO3 =-0,00655 + 0,00617 = -0,00038 Ом-1 м2 г-экв-1.
Знак '-' перед электропроводностью l 0Cl говорит о том, что концентрация Cl в результате титрования уменьшается. Знак '+' перед l 0NO3 свидетельствует об увеличении концентраци NO3.
Полученное в итоге отрицательное число -0,00038 Ом-1 м2 г-экв-1 указывает на то, что при титрованиии до точки эквивалентности электропроводность раствора уменьшается.
После точки эквивалентности электропроводность будет повышатьcя, так как эту ветвь титрования полностью определяет титрант, т.е. ионы Ag и NO3:
l 0Ag + l 0NO3 = 0,005436 + 0,00617 = 0,011606 Ом-1 м2 г-экв-1.
Прошу обратить внимание на то, что полученное число положительно, что говорит об увеличении электропроводности раствора с каждой порцией титранта.
Кривой титрования (рис. 2б) на рисунке может соответствовать титрование ацетата натрия соляной кислотой. Почему? Потому, что до точки эквивалентности электропроводность раствора будет возрастать, а не убывать как в предыдущем случае:
-l 0ацетат + l 0Cl = -0,0034 + 0,00655 = 0,00315 Ом-1 м2 г-экв-1.
В заключении хочу предупредить о том, что любое отклонение кривой титрования от описанных выше видов, должно настораживать, так как при этом увеличивается вероятность появления больших систематических ошибок. Подозрение должны вызывать нелинейные ветви кривой титрования, максимум на кривой титрования и т.п.
Рекомендуем скачать другие рефераты по теме: реферат влияние, реферати українською.
Категории:
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
 Главная
Главная