
Синергетика – теория самоорганизации
| Категория реферата: Рефераты по науке и технике
| Теги реферата: правила реферата, источники реферат
| Добавил(а) на сайт: Doroga.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
Большие успехи термодинамики, ее глубокая связь со статистической физикой, исследованная в конце XIX в., привели к мысли, что эти методы можно применить и для изучения более широкого класса систем.
В тридцатые годы были заложены основы линейной неравновесной термодинамики, которая «охватывает все случаи, когда потоки (или скорости необратимых процессов) являются линейными функциями «термодинамических сил» (градиентов температуры или концентраций). Такой подход оказался очень плодотворным.
Однако позже выяснилось, что некоторые процессы в эту схему не укладываются. Ученые брюссельской научной школы под руководством бельгийского ученого И.Пригожина для их объяснения предложили содержательные нелинейные модели, в которых используются величины, характерные для термодинамики (концентрации, температуры и т.д.). Работы И.Пригожина по теории необратимых процессов в открытых неравновесных системах были удостоены Нобелевской премии по химии 1977г.
Модель брюсселятора является одной из самых известных математических моделей синергетики. (Название связано с тем, что она была предложена в брюссельской научной школе.) Эта модель описывает распределение по пространству и изменение со временем реагентов сравнительно узкого класса химических реакций, однако при ее исследовании были выяснены свойства диссипативных структур во многих нелинейных системах.
Из школьного курса химии известен закон действующих масс. В реакции, где два вещества, Х и Y, реагируя, дают вещество Z (Х + Y → Z), скорость изменения вещества Z пропорциональна произведению концентраций веществ X и Y. Коэффициент пропорциональности – постоянная реакции k. Обозначая через X, Y, Z концентрации соответствующих веществ, можно записать
|
|
(1) |
В самом деле, для того чтобы реакция шла, молекулы вещества X должны сталкиваться с
молекулами Y. Очевидно, вероятность этого пропорциональна числу молекул X в
единице объема (т.е. концентрации![]() ). Точно так
же она должна быть пропорциональна концентрации
). Точно так
же она должна быть пропорциональна концентрации![]() .
Коэффициент пропорциональности k зависит от размеров молекул, их скоростей и
т.д. Все это и отражает формула (1). Если в реакции п молекул Х взаимодействуют
с одной молекулой Y, то изменение концентрации вещества Z пропорционально XnY.
.
Коэффициент пропорциональности k зависит от размеров молекул, их скоростей и
т.д. Все это и отражает формула (1). Если в реакции п молекул Х взаимодействуют
с одной молекулой Y, то изменение концентрации вещества Z пропорционально XnY.
Обратимся теперь к самой модели. Пусть в некотором химическом реакторе превращения идут по следующей схеме:
A ↔ X, B + X ↔ Y + D, 2X + Y ↔ 3X, X ↔ E.
Концентрации
веществ А и В в реакторе поддерживаются постоянными, и некоторым образом
удаляются вещества D и Е, т. е. система является открытой. Будем считать, что
скорости обратных реакций (k–1, k–2, k–3, k–4)
гораздо меньше скоростей прямых реакций (k1, k2, k3, k4). В этих предположениях, обозначая через ![]() концентрацию
вещества X,
концентрацию
вещества X,![]() – вещества A
и т.д., получим из закона действующих масс следующую систему уравнений:
– вещества A
и т.д., получим из закона действующих масс следующую систему уравнений:
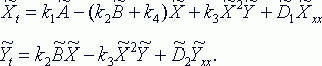
Концентрации
реагентов ![]() и
и ![]() могут быть
различными в разных точках, поэтому в уравнение входят члены D1
могут быть
различными в разных точках, поэтому в уравнение входят члены D1![]() xx, D2
xx, D2![]() xx, учитывающие
их диффузию. После несложных замен переменных, эквивалентных переходу к другой
системе единиц
xx, учитывающие
их диффузию. После несложных замен переменных, эквивалентных переходу к другой
системе единиц
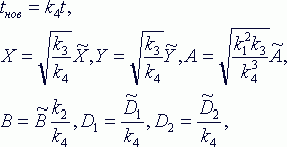
мы придем к системе уравнений в частных производных, называемых моделью брюсселятора:
|
Xt = A – (B+1)X + X2Y
+ D1Xxx, |
(2) |
Вещества X и Y остаются в реакторе, поэтому потребуем выполнения следующих краевых условий:
|
Xx(0, t) = Xx(l, t) = 0, |
(3) |
Поведение решений
Посмотрим, есть ли у уравнения (3) какие-нибудь простые решения, например не меняющиеся со временем (их называют стационарными) и однородные по пространству. При этом все производные в (3) становятся нулевыми и мы имеем систему обычных алгебраических уравнений:
А – (B + 1)X + X2Y = 0, BX – X2Y = 0
Ее единственное решение – это Х = А, Y = B/А. В наших рассуждениях оно будет играть особую роль. Будем менять концентрацию вещества B и начальные распределения концентраций X(х, 0), Y(x, 0) и смотреть, как меняется поведение решения. В этом нам опять поможет ЭВМ.
Если концентрация вещества B невелика, то независимо от начальных данных через определенное время установятся концентрации Х(x, t) = A, Y(x, t) = B/A. Оказывается, такое замечательное решение (устойчивое стационарное, на которое независимо от начальных данных выходят изучаемые распределения параметров при небольших внешних воздействиях) есть у многих нелинейных систем. Оно получило название термодинамической ветви (в случае брюсселятора это решение Х = А, Y = B/A).
На первый взгляд кажется, что такая картина будет иметь место при любых В. Однако это не так. Если зафиксировать начальные концентрации Х(х, 0), Y(х, 0) и увеличивать значение B, то мы увидим, что начиная с некоторого критического значения B происходит выход на немонотонные стационарные распределения концентраций, например такие, как показаны на рис.1 и 2.
Рекомендуем скачать другие рефераты по теме: ценные бумаги реферат, военные рефераты.
Категории:
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
 Главная
Главная