
Исторический очерк биохимии
| Категория реферата: Биология и химия
| Теги реферата: контрольная работа по математике класс, купить диплом высшее
| Добавил(а) на сайт: Bessonov.
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
О механизме общего неблагоприятного воздействия на организм дефицита витамина А, в смысле его влияния на рост, массу тела и устойчивость по отношению к инфекционным возбудителям, можно судить по некоторым биохимическим и морфологическим изменениям. Отставание роста и массы тела связывается с нарушением белкового обмена. Это отставание проявляется ещё больше при усилении катаболических процессов, обусловленными продолжительными вторичными инфекциями кожи и слизистых. Нарушение окостенения в эпифизах длинных трубчатых костей вызывает замедление роста в длину.
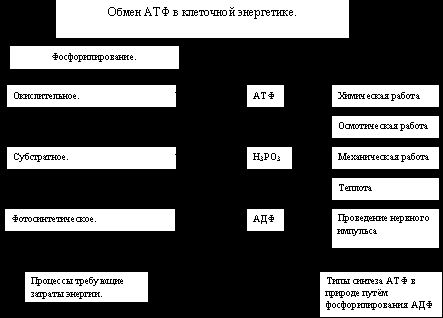
Роль АТФ.
Как известно в биоэнергетике живых организмов имеют значение два основных момента:
а) химическая энергия запасается путём образования АТФ, сопряжённого с экзергоническими катаболическими реакциями окисления органических субстратов;
б) химическая энергия утилизируется путём расщепления АТФ, сопряжённого с эндергоническими реакциями анаболизма и другими процессами, требующими затраты энергии.
Встаёт вопрос, почему молекула АТФ соответствует своей центральной роли в биоэнергетике. Для его разрешения рассмотрим структуру АТФ
Структура АТФ4 –( при рН 7,0 тетразаряд аниона).
АТФ представляет собой термодинамически нестойкое соединение. Нестабильность АТФ определяется, во – первых, электростатическим отталкиванием в области кластера одноимённых отрицательных зарядов, что приводит к напряжению всей молекулы, однако сильнее всего связи – Р – О – Р, и во – вторых, конкретным резонансом. В соответствии с последним фактором существует конкуренция между атомами фосфора за неподелённые подвижные электроны атома кислорода, расположенного между ними, поскольку на каждом атоме фосфора имеется частичный положительный заряд в следствии значительного электронаицепторного влияния групп Р=О и Р – О-. Таким образом, возможность существования АТФ определяется наличием достаточного количества химической энергии в молекуле, позволяющей компенсировать эти физико – химические напряжения. В молекуле АТФ имеется две фосфоангидридных (пирофосфатных) связи, гидролиз которых сопровождается значительным уменьшением свободной энергии (при рН 7,0 и 37оС).
АТФ+Н2О = АДФ + Н3РО4 ΔG0I = -31,0 КДж/моль.
АДФ+Н2О = АМФ +Н3РО4 ΔG0I = -31,9 КДж/моль.
Одной из центральных проблем биоэнергетики является биосинтез АТФ, который в живой природе происходит путём Фосфорилирование АДФ.
Фосфорилирование АДФ является эндергоническим процессом и требует источника энергии. Как отмечалось ранее, в природе преобладает два таких источника энергии – это солнечная энергия и химическая энергия восстановленных органических соединений. Зелёные растения и некоторые микроорганизмы способны трансформировать энергию, поглощённых квантов света в химическую энергию, которая расходуется на фосфорилирование АДФ в световой стадии фотосинтеза. Этот процесс регенерации АТФ получил название фотосинтетического фосфорилирования. Трансформация энергии окисления органических соединений в макроэнергетические связи АТФ в аэробных условиях происходит преимущественно путём окислительного фосфорилирования. Свободная энергия, необходимая для образования АТФ, генерируется в дыхательной окислительной цепи митаходрий.
Известен ещё один тип синтеза АТФ, получивший название субстратного фосфорилирования. В отличии от окислительного фосфорилирования, сопряжённого с переносом электронов, донором активированной фосфорильной группой (- РО3 Н2), необходимой для регенерации АТФ, являются интермедианты процессов гликолиза и цикла трикарбоновых кислот. Во всех этих случаях окислительные процессы приводят к образованию высокоэнергетических соединений: 1,3 – дифосфоглицерата (гликолиз), сукцинил – КоА (цикл трикарбоновых кислот), которые при участии соответствующих ферментов способны фолирировать АДФ и образовывать АТФ. Трансформация энергии на уровне субстрата является единственным путём синтеза АТФ в анаэробных организмах. Этот процесс синтеза АТФ позволяет поддерживать интенсивную работу скелетных мышц в периоды кислородного голодания. Следует помнить, что он является единственным путём синтеза АТФ в зрелых эритроцитах не имеющих митохондрий.
Особо важную роль в биоэнергетике клетки играет адениловый нуклеотид, и которому присоединены два остатка фосфорной кислоты. Такой вещество называется аденозинтрифосфорной кислотой (АТФ). В химических связях между остатками фосфорной кислоты молекулы АТФ запасена энергия, которая освобождается при отщеплении органического фосфорита: АТФ= АДФ+Ф+Е, где Ф – фермент, Е – освобождающая энергия. В этой реакции образуется аденозинфосфорная кислота (АДФ) – остаток молекулы АТФ и органический фосфат. Энергию АТФ все клетки используют для процессов биосинтеза, движения, производство тепла, нервных импульсов, свечений (например, улюминисцентных бактерий), то есть для всех процессов жизнедеятельности.
АТФ – универсальный биологический аккумулятор энергии. Световая энергия, заключенная в потребляемой пище, запасается в молекулы АТФ.
Запас АТФ в клетке невелик. Так, в мышце запаса АТФ хватает на 20 – 30 сокращений. При усиленной, но кратковременной работе мышцы работают исключительно за счёт расщепления содержащейся в них АТФ. После окончания работы человек усиленно дышит – в этот период происходит расщепление углеводов и других веществ ( происходит накопление энергии) и запас АТФ в клетках восстанавливается.
Глюкоза. Формула глюкозы.
Сахара имеют общую формулу С(Н2О)n, где n – целое число (от 3 до 7).
Всё сахара содержат гидроксильные, а также либо альдегидные, либо китонные группировки. Взаимодействую друг с другом, моносахара могут образовывать ди-, три- или олигосахариды. Сахара являются главным энергетическим субстратом клеток. Кроме того, они образуют связи с белками и липидами, а также являются строительными блоками при образовании более сложных биологических структур. Основными реакционоспособными группировками сахаров являются гидроксильные группы, участвующие, в частности, в образовании связей между мономерами.
Во всех клетках способных метаболизировать глюкозу, первой реакцией является её фосфорилирование до глюкозо – 6 – фосфата. Реакция катализируется ферментом гексокиназой, а донором фосфорильной группы является молекула АТФ.
Эта реакция практически необратима, дельта G0I= -16,74 КДж/моль. Гексокиназа, присутствующая во всех тканях, за исключением паренхимы печени имеет высокое средство к глюкозе, а также способна фосфорилировать и другие гексозы, но значительно с меньшей скоростью. В клетках печени эту функцию выполняет глюкокиназа, активность которой зависит от питания. Глюкокиназа специфична к глюкозе и эффективно функционирует только при высокой концентрации в крови глюкозы. Важным свойством глюкокиназы является ингибирование продуктом реакции глюкозо – 6 – фосфатом по аллостерическому механизму.
Фосфорилированная глюкоза не способна проходить через цитоплазматическую мембрану и оказывается “запертой” в клетке. Таким образом, глюкозо – 6 – фосфат является центральным метаболитом углеводного обмена и занимает важное положение в интеграции ряда метаболических путей (гликолиз, глюкогинез, пентозофосфатный путь, гликогенолиз).
Обратный процесс дефосфорилирования глюкозы идёт только в трёх тканях, клетки которых способны транспортировать глюкозу в кровь, а именно ткани печени, эпителия почечных канальцев тонкого кишечника. Это становится возможным благодаря действию гидролитического фермента глюкозо – 6 – фосфатазы, который катализирует реакцию:
О регуляции активности этого фермента до сих пор известно мало, а следовательно, неясно, какие факторы предотвращают непрерывный цикл фосфорилирования и дефосфорилирования глюкозы.
В растительном мире огромные количества глюкозы образуется путём восстановления диоксида углерода в процессе фотосинтеза. В организме животных глюкоза непрерывно синтезируется в строго регулируемых реакциях из простых предшественников. Предшественниками могут быть: 1) пируват или лактат; 2) некоторые аминокислоты; 3) любой другой компонент, который в процессе катаболизма может превращён в пируват или один из метаболитов ЦТК.
Биосинтез глюкозы из неуглеводных предшественников носит название глюконеогенез, а пируват обуславливает вхождение в этот процесс. Как отмечалось выше, в процесс глюконеогенеза вовлекают ряд аминокислот, после превращения их в пируват или оксалоацетат. Также аминокислоты получили название глюкогенных. Из продуктов деградации триацилглицералов только глицерол может участвовать в глюконеогенезе путём превращения его в дегидроксиацетон ( метаболит гликолиза), а затем в глюкозу.
Подобно тому как гликолиз представляет собой центральный путь катаболизма глюкозы, в процессе которого она распадается до двух молекул пирувата, превращение последних в глюкозу составляет центральный путь глюконеогенеза. Таким образом, глюконеогенез в основном протекает по тому же пути, что и гликолиз, но в обратном направлении. Однако три реакции гликолиза ( глюкоза > глюкозо – 6 – фосфат; фруктозо – 6 – фосфат > фруктозо – 1,6 – дифосфат; фосфоеноилпируват > пируват) необратимы, и в обход этих реакций в глюконеогенезе протекают другие реакции с иной стехиометрией, катализируемые другими ферментами. Известны 4 фермента, катализирующие реакции глюконеогенеза и не принимающие участие в гликолизе: пируваткарбоксилаза, фосфоеноилпируваткарбоксилаза, фруктозо – 1,6 – диофосфотаза, глюкозо – 6 – фосфотаза.
Рекомендуем скачать другие рефераты по теме: курсовые работы, сочинение.
Категории:
Предыдущая страница реферата | 1 2 3 | Следующая страница реферата
 Главная
Главная