Расчет угловых
множителей по данным угловых координат лигандов (таблица 1) приводит выражения
для энергии d – орбиталей комплекса (1) к виду:
 (2)
(2)
Таким образом, приравнивая энергию переходов между d-орбиталями, выраженную через параметры
МУП, со значениями этих энергий, найденными из гауссиан анализа
экспериментального электронного спектра, получаем систему уравнений для каждого
варианта расположения энергетических уровней. Решая полученные уравнения
относительно радиальных параметров МУП и анализируя их значения, характерные
для координационных соединений, определяется правильный вариант расположения
энергетических уровней.
Предложена также
методика для расчета частот и форм нормальных колебаний молекул, исходя из
данных об их геометрическом строении и силовом поле с использованием решения
прямой колебательной задачи путем нахождения собственных значений и собственных
векторов в уравнении Шредингера методом приведения к матрице Хессенберга и
использованием QR алгоритма с неявными сдвигами. Встроенная в программу база
данных по геометрии фрагментов молекул и молярных масс атомов облегчает
определение структуры химических соединений, поскольку достаточно изменить одну
переменную и тогда все элементы матрицы, содержащей кинетические параметры, использующие ее, пересчитываются автоматически.
В третьей главе
приведены результаты экспериментального исследования.
В разделе 3.1 описано
изучение бинарных комплексов N-фосфонометилглицина с медью(II) методами
потенциометрии и электронной спектроскопии, а также определение влияния
аминокислоты (валина) на процесс комплексообразования.
По значениям констант
депротонирования лигандов в условиях исследования процессов
комплексообразования (температура, ионная сила), определенных нами методом рН
метрии, были рассчитаны диаграммы распределения, представленные на рисунке 1.
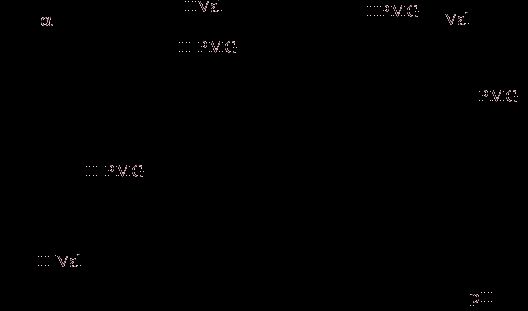
Рисунок 1. Диаграмма
распределения различных форм N-фосфономе-тилглицина и валина.
В системе Cu2+-H3PMG
константы устойчивости комплексов убывают в ряду  , что в первом
случае соответствует переходу от тридентатного связывания с образованием двух
пятичленных хелатных колец к бидентатному с восьмичленным циклом, а во втором –
объясняется стерическими затруднениями при образовании связи с двукратно
протонированной фосфоновой группой.
, что в первом
случае соответствует переходу от тридентатного связывания с образованием двух
пятичленных хелатных колец к бидентатному с восьмичленным циклом, а во втором –
объясняется стерическими затруднениями при образовании связи с двукратно
протонированной фосфоновой группой.
Для тройных систем
Cu2+-H3PMG-HVal нами были получены значения констант устойчивости  разнолигандных комплексов Cu(PMG)Val2-
(lgβ1110 = 19.81(4)) и Cu(HPMG)Val- (lgβ1111 = 26.02(6)) и рассчитаны
диаграммы распределения иона металла (рисунок 2). Образованию комплексов
Cu(H2PMG)(HVal)+, Cu(HPMG)(HVal), Cu(HPMG)Val-, Cu(PMG)Val2-, по всей видимости, препятствует большая устойчивость при низких значениях рН бис-комплексов с
формами HPMG2- и H2PMG-, способными образовывать хелатные комплексы.
разнолигандных комплексов Cu(PMG)Val2-
(lgβ1110 = 19.81(4)) и Cu(HPMG)Val- (lgβ1111 = 26.02(6)) и рассчитаны
диаграммы распределения иона металла (рисунок 2). Образованию комплексов
Cu(H2PMG)(HVal)+, Cu(HPMG)(HVal), Cu(HPMG)Val-, Cu(PMG)Val2-, по всей видимости, препятствует большая устойчивость при низких значениях рН бис-комплексов с
формами HPMG2- и H2PMG-, способными образовывать хелатные комплексы.
Большую устойчивость
комплекса Cu(PMG)Val2 по сравнению с Cu(PMG) можно
объяснить вхождением в координационную сферу иона металла меньшего по объему по
сравнению с PMG3- хелатообразующего валинат-иона, также занимающего два места в
экваториальной плоскости комплекса. По сравнению с Cu(Val)2 тройной комплекс
устойчив за счет тридентатного характера связывания глифосат-аниона.
можно
объяснить вхождением в координационную сферу иона металла меньшего по объему по
сравнению с PMG3- хелатообразующего валинат-иона, также занимающего два места в
экваториальной плоскости комплекса. По сравнению с Cu(Val)2 тройной комплекс
устойчив за счет тридентатного характера связывания глифосат-аниона.


Рисунок. 2. Диаграммы
распределения металла для растворов с соотношениями сCu: сPMG : сVal = 1:1:1
(а) и 1:2:2 (б) (сCu=0.0015 моль/л, 0.1 М KCl).
В электронных спектрах в
системе Cu2+-H3PMG при увеличении рН и соотношения сPMG: сCu возрастает
оптическая плотность, максимум полосы поглощения смещается в длинноволновую
область не превышая значения 14500 см-1, что означает присутствие не более
одного атома азота в экваториальной плоскости комплекса, то есть в комплексе
Cu(PMG)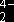 одна из
донорных групп не принимает участия в связывании и один из лигандов
координирован бидентатно. Об этом также свидетельствует его константа
устойчивости, которая намного ниже ожидаемой при одинаковой координации обоих
лигандов.
одна из
донорных групп не принимает участия в связывании и один из лигандов
координирован бидентатно. Об этом также свидетельствует его константа
устойчивости, которая намного ниже ожидаемой при одинаковой координации обоих
лигандов.
Добавление в систему
валина смещает сигнал в длинноволновую область и при рН > 8 максимум полосы
поглощения имеет значение свыше 14500 см-1, что подтверждает нахождение в
экваториальной плоскости комплекса двух донорных атомов азота.
Значения констант
устойчивости, полученные в ходе компьютерной обработки оптических спектров, соответствуют данным рН метрического титрования, что свидетельствует о
корректности выбранной схемы равновесий. Нами предложены следующие способы
координации в разнолигандных комплексах:

Cu(HPMG)Val- Cu(PMG)Val2–
В разделе 3.2 описано
исследование строения комплексов Cu(II) с
2-[2-гидроксифенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином (I) и
2-[2-гидрокси-5-нитрофенил]-4,4-дифенил-1,2-дигидро-4Н-3,1-бензоксазином (II)
методами ЭПР и электронной спектроскопии.
Рекомендуем скачать другие рефераты по теме: биология 6 класс, курсовая работа по экономике.
Предыдущая страница реферата |
1
2
3
4
5
6
7
8
9
10
11 |
Следующая страница реферата

 (2)
(2)
 разнолигандных комплексов Cu(PMG)Val2-
(lgβ1110 = 19.81(4)) и Cu(HPMG)Val- (lgβ1111 = 26.02(6)) и рассчитаны
диаграммы распределения иона металла (рисунок 2). Образованию комплексов
Cu(H2PMG)(HVal)+, Cu(HPMG)(HVal), Cu(HPMG)Val-, Cu(PMG)Val2-, по всей видимости, препятствует большая устойчивость при низких значениях рН бис-комплексов с
формами HPMG2- и H2PMG-, способными образовывать хелатные комплексы.
разнолигандных комплексов Cu(PMG)Val2-
(lgβ1110 = 19.81(4)) и Cu(HPMG)Val- (lgβ1111 = 26.02(6)) и рассчитаны
диаграммы распределения иона металла (рисунок 2). Образованию комплексов
Cu(H2PMG)(HVal)+, Cu(HPMG)(HVal), Cu(HPMG)Val-, Cu(PMG)Val2-, по всей видимости, препятствует большая устойчивость при низких значениях рН бис-комплексов с
формами HPMG2- и H2PMG-, способными образовывать хелатные комплексы.


 Главная
Главная