
Строение веществ. Систематика химических элементов
| Категория реферата: Биология и химия
| Теги реферата: куплю диплом о высшем образовании, реферат мировой
| Добавил(а) на сайт: Царско.
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 | Следующая страница реферата
Тогда
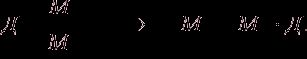
Объединенный газовый закон:
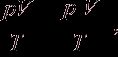
р0 = 101325 Па, Т0 = 0 ºС (273,15 К),
где р0, V0, Т0 – соответственно давление, объем, температура при н.у.; р, V, Т – те же параметры данного количества газообразного вещества при других условиях.
Для
1 моль любого газа при н.у.: 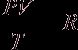 - универсальная газовая постоянная.
- универсальная газовая постоянная.
R = 8,314 Дж/(моль×К)
Для 1 моля газа тогда имеем:
![]()
Это уравнение состояния идеального газа.
Если количество газа другое, то получим уравнение Менделеева – Клапейрона:
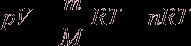 (n – число молей данного вещества).
(n – число молей данного вещества).
Закон парциальных давлений: общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь:
![]()
где р – общее давление; р1, р2 … - парциальные давления газов 1, 2 …
Парциальное давление газа в смеси – давление, которое производило бы это же количество данного газа, если бы он один занимал при этой же температуре весь объем, занимаемый смесью.
Строение атома
Атом – электронейтральная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Ядра атомов состоят из двух типов частиц (нуклонов) – протонов (р) и нейтронов (n). Заряд протона равен по величине и противоположен по знаку заряду электрона; масса его равна приблизительно одной а.е.м. Нейтрон – незаряженная частица с массой, приблизительно равной массе протона.
Линейные размеры атома - ~10-8 см, ядра - ~10-12-10-13 см.
Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, равным сумме чисел протонов (заряда ядра) Z и нейтронов N: А=Z+N.
Главной характеристикой атома является заряд ядра (Z). Он определяет число электронов, находящихся вокруг ядра, т.е. принадлежность атома к данному виду химических элементов, и соответствует атомному номеру (в периодической системе элементов – порядковому номеру) элемента.
В
обозначении атома элемента отражаются массовое число и количество протонов - ![]() , например
, например ![]() .
.
Относительная
атомная масса элемента является средней величиной массовых чисел его природных
изотопов с учетом степени их распространения. Например, хлор в природе
находится в основном в виде двух изотопов - ![]() (75,43%) и
(75,43%) и ![]() (24,57%).
Относительная атомная масса хлора составляет
(24,57%).
Относительная атомная масса хлора составляет  .
.
Основой современной теории строения атома являются законы и положения квантовой (волновой) механики – раздела физики, изучающего движение микрообъектов.
Микрообъекты обладают одновременно корпускулярными и волновыми свойствами. Для описания движения микрочастиц используется вероятностный подход, то есть определяется не их точное положение, а вероятность нахождения в той или иной области околоядерного пространства.
Рекомендуем скачать другие рефераты по теме: доклад на тему, сочинение рассуждение на тему.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 7 8 9 | Следующая страница реферата
 Главная
Главная