
Зависимость изменения скорости протекания электролиза от концентрации электролита
| Категория реферата: Биология и химия
| Теги реферата: дипломные работы бесплатно, скачать ответы
| Добавил(а) на сайт: Конаков.
Предыдущая страница реферата | 7 8 9 10 11 12 13 14 15 16 17 | Следующая страница реферата
3 – анод.
В медном кулонометре катод и анод изготавливают из меди. Раствор содержит 50 г/л серной кислоты (уд. в. 1,84), 150 г/л медного купороса и 50 г/л сахара. Сахар необходим для предотвращения реакции, происходящей в электролите:
Сu+ ® Cu2+ +Cu¯
Процесс ведут при плотности тока в электродах 0,002 – 0,02 А/см2. Медный кулонометр не обеспечивает высокой точности (ошибка ~0,2 процента), так как в электродах образуются ионы Cu+ и на катоде восстанавливается кислород, попадающий в раствор из воздуха.
В ртутном кулонометре анодом служит ртуть, катодом – графит, электролитом – раствор, содержащий 225 г/л йодистой ртути и750 г/л йодистого калия. При электролизе металл анода окисляется и переходит в раствор в виде ионов Hg2+. На катоде происходит их восстановление и накапливается металлическая ртуть, которая стекает в градуированную (в кулонах) трубку. Ртутный кулонометр дает большую ошибку (около 1 процента), но удобен при измерении больших количеств вещества и позволяет работать с большими плотностями тока (I < 0.1 А/см2).
В газовом кулонометре электродами служат никелевые пластинки. Электровводы, проходящие через стеклянную стенку кулонометра внутрь ячейки, делают из молибденовой проволоки, которая хорошо впаивается в стекло. Электролитом служит 15-процентный раствор сернокислого натрия или 20-процентный раствор едкого натра. Электролиз ведут при катодной плотности тока не выше 0,04 А/см2. Количество электричества рассчитывают по объёму водорода и кислорода в эвдиометре. Подставив значение g из уравнения Менделеева – Клапейрона в уравнение
g=N*э = (э*I*t)/F, получим
Q = I*t = (g*F)/э = (P*v*M)/R*T * (F/э) * 2/3 =
= 2.064074*(P –PH2O)*v/T (k)
В этом уравнении расчет ведется на водород. Поэтому в уравнении введен коэффициент 2/3, так как водород составляет 2/3 от объёма газовой смеси.
По количеству электричества, пошедшего через кулонометр (Qk), включенного последовательно в цепь с электролизёром, можно определить выход по току (g), если известно количество вещества (g), выделившегося на катоде или аноде электролизера. Для этого из уравнения g=N*э = (э*I*t)/F рассчитывают количество электричества, пошедшего на данную электродную реакцию (Qэ).
Qэ = g*F/э.
И далее находят выход по току в процентах:
g = Qэ / Qk*100%
С помощью кулонометра по количеству электричества, которое необходимо для полного выделения вещества, для электродной реакции
Ох + ne®Red
или
Red - ne®Ox,
Можно определить концентрацию этого вещества в растворе (если известна n) или величину n (если известна концентрация).
При проведении кулонометрического анализа побочные электродные реакции в электролизёре, снижающие выход по току, должны быть исключены.
Так как окислительно-восстановительные потенциалы для большинства веществ известны, то побочных реакций можно избежать, если процесс вести при строго определенном потенциале, при котором другие вещества ещё не выделяются. Непременным условием аналитического определения является обнаружение конца реакции. Если реакция ведется при постоянном потенциале, то на её завершение указывает падение силы тока в цепи до нуля.
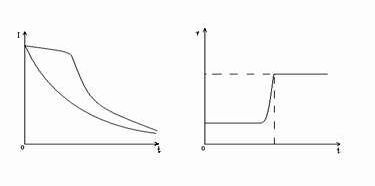
А Б
рис. 4 Графики зависимости силы тока и потенциала от времени:
а – изменение силы тока при постоянном потенциале.
Рекомендуем скачать другие рефераты по теме: исторические рефераты, контрольная работа 3.
Категории:
Предыдущая страница реферата | 7 8 9 10 11 12 13 14 15 16 17 | Следующая страница реферата
 Главная
Главная