
Зависимость изменения скорости протекания электролиза от концентрации электролита
| Категория реферата: Биология и химия
| Теги реферата: дипломные работы бесплатно, скачать ответы
| Добавил(а) на сайт: Конаков.
Предыдущая страница реферата | 7 8 9 10 11 12 13 14 15 16 17
б – изменение потенциала при постоянной силе тока.
Однако для достижения полного выделения вещества требуется много времени, так как сила тока во времени уменьшается плавно (рис. 4-а).
При постоянной силе тока на завершение реакции указывает резкое изменение потенциала, например при анодном растворении цинкового покрытия с железного изделия (рис. 4-б).
9. Кулонометрический анализ при постоянном потенциале.
Схема электрической цепи для кулонометрического анализа при постоянном потенциале приведена на рисунке 5. Для поддержания потенциала электрода необходимо чтобы сила тока проходящего через сопротивление r1и r2 была в 10 – 100 раз больше, чем в боковой цепи. Этого можно достигнуть, если сопротивление r1 будет в 10 – 100 раз меньше суммарного сопротивления в боковой цепи, что устанавливается в каждом случае опытным путем.
В качестве источника постоянного тока можно взять батарею аккумуляторов на 12 в или селеновые выпрямители, чтобы ёмкость источника тока была большой. Зарядный потенциал поддерживается с помощью сопротивлений R1 и R2 и контролируется потенциометром. Лучше пользоваться показывающим потенциометром ЛПУ – 01. Можно пользоваться также и другими потенциометрами с высокоомным входом. Электродом сравнения может служить насыщенный каломельный электрод fкалом = 0,243 в. В тех случаях, когда перенос продуктов анодной реакции на катод или продуктов катодной реакции на анод снижает выход по току и недопустим, электрод, по которому не ведут расчет, помещают в пористый сосуд или стеклянную трубку, со стеклянным фильтром, заполненным растворами сернокислого натрия, азотнокислого калия или серной кислоты.
Влияние кислорода по катодному току исключают барбатированием водорода, азота или инертного газа. Мешалка необходима для выравнивания концентрации вещества в полном объеме. Тип кулонометра, включаемого в измерительную цепь, определяется допустимой погрешностью измерений.
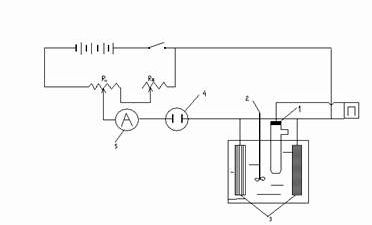
рис. 5 Схема электрической цепи для кулонометрического анализа при постоянном потенциале.
П – потенциометр
1 – электрод сравнения 5 - миллиамперметр
2 – мешалка R1 и R2 – переменные
3 – электроды сопротивления
4 - кулонометр
Работа сводится к наложению на электрод потенциала (при котором возможна лишь одна реакция), к его поддержанию на заданном уровне, к установлению конца реакции и к определению количества протекшего электричества. Так как для достижения 100-процентного выделения вещества из раствора требуется много времени, то электролиз прекращают, когда сила тока уменьшится в 100 – 500 раз. Процесс заканчивается тем быстрее, чем больше площадь электрода, на котором происходит разряд вещества, и чем меньше объём электролита.
Катодное восстановление веществ с аналитической целью часто проводят на ртути. В этом случае перенапряжение водорода так высоко, что оно не мешает определению.
10. Заключение.
Теоретическое значение открытых закономерностей было очень велико. Они подтвердили атомистическую природу электричества. Законы, установленные Фарадеем, дали возможность применять процессы электролиза па практике и позволили делать количественные расчеты. Оказалось, что законы Фарадея в полной мере применимы к электродным процессам, происходящим в гальванических элементах при их работе.
Скачали данный реферат: Babykin, Виноградов, Pestov, Lebedinskij, Jagunkin, El'cin.
Последние просмотренные рефераты на тему: русский язык 7 класс изложение, контрольные работы по алгебре класс, отчет по практике, реферат русь.
Категории:
Предыдущая страница реферата | 7 8 9 10 11 12 13 14 15 16 17
 Главная
Главная