
Теория электролитической диссоциации
| Категория реферата: Рефераты по науке и технике
| Теги реферата: сочинение тарас, курсовики скачать бесплатно
| Добавил(а) на сайт: Мазур.
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата
Решение.
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1 • m1, в растворе №2 - w2 • m2. Масса образовавшегося раствора (№3) - (m1 - m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w1 • m1 + w2 • m2 = w3 • (m1 + m2)
w1 • m1 + w2 • m2 = w3 • m1 + w3 • m2
w1 • m1 - w3 • m1 = w3 • m2 - w2 • m2
(w1- w3) • m1 = (w3- w2) • m2
m1 / m2 = (w3 - w2 ) / (w1- w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :
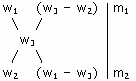
m1 / m2 = (w3 - w2) / (w1 - w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 - w3), w1 > w3 и (w3 - w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример.
Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
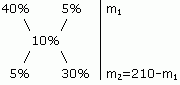
5 / 30 = m1 / (210 - m1)
1/6 = m1 / (210 - m1)
210 - m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 - m1 = 210 - 30 = 180 г
Разбавление раствора.
Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (r1 • V1) откуда V1= m1 /( w1 • r1)
w2 = m2 / (r2 • V2)
m2 = w2 • r2 • V2
Рекомендуем скачать другие рефераты по теме: индия реферат, учебный реферат.
Категории:
Предыдущая страница реферата | 1 2 3 4 5 6 | Следующая страница реферата
 Главная
Главная