|
44,1
|
280,5
|
Белый кристаллический порошок, ядовит, самовозгорается на
воздухе. При 280—300°С переходит в красный
|
|
Красный
|
2,3
|
590
|
Возгоняется около 400°С
|
Красный кристаллический или аморфный порошок, неядовит.
При 220°С и 12 × 108 Па переходит в черный фосфор. Загорается на воздухе
только при поджигании
|
|
Черный
|
2,7
|
При нагревании переходит в красный фосфор
|
Графитоподобная структура. При нормальных условиях —
полупроводник, под давлением проводит электрический ток как металл
|
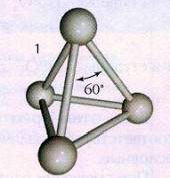 Белая модификация фосфора, получающаяся при конденсации
паров, имеет молекулярную кристаллическую решетку, в узлах которой
дислоцированы молекулы Р4 (рис.1). Из-за слабости межмолекулярных сил белый
фосфор летуч, легкоплавок, режется ножом и растворяется в
неполярных растворителях, например в сероуглероде. Белый фосфор весьма
реакционноспособное вещество. Он энергично взаимодействует с кислородом, галогенами, серой и металлами. Окисление фосфора на воздухе сопровождается
разогреванием и свечением. Поэтому белый фосфор хранят под водой, с которой он
не реагирует. Белый фосфор очень токсичен.
Белая модификация фосфора, получающаяся при конденсации
паров, имеет молекулярную кристаллическую решетку, в узлах которой
дислоцированы молекулы Р4 (рис.1). Из-за слабости межмолекулярных сил белый
фосфор летуч, легкоплавок, режется ножом и растворяется в
неполярных растворителях, например в сероуглероде. Белый фосфор весьма
реакционноспособное вещество. Он энергично взаимодействует с кислородом, галогенами, серой и металлами. Окисление фосфора на воздухе сопровождается
разогреванием и свечением. Поэтому белый фосфор хранят под водой, с которой он
не реагирует. Белый фосфор очень токсичен.
Около 80% от всего производства белого фосфора идет на
синтез чистой ортофосфорной кислоты. Она в свою очередь используется для
получения полифосфатов натрия (их применяют для снижения жесткости питьевой
воды) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется для
создания дымообразующих веществ и зажигательных смесей.
Техника безопасности. В
производстве фосфора и его соединений требуется соблюдение особых мер
предосторожности, т.к. белый фосфор – сильный яд. Продолжительная работа в атмосфере
белого фосфора может привести к заболеванию костных тканей, выпадению зубов, омертвению участков челюстей. Воспламеняясь, белый фосфор вызывает болезненные, долго не заживающие ожоги. Хранить белый фосфор следует под водой, в
герметичных сосудах. Горящий фосфор тушат двуокисью углерода, раствором CuSO4 или песком. Обоженную кожу следует промыть раствором KmnO4 или CuSO4. Противоядием
при отравлении фосфором является 2%-ый
раствор CuSO4.
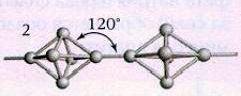 При длительном хранении, а также при нагревании белый
фосфор переходит в красную модификацию (впервые его получили лишь 1847 году).
Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске:
она колеблется от оранжевой до темно-красной и даже фиолетовой. Все
разновидности красного фосфора нерастворимы в органических растворителях, и по
сравнению с белым фосфором они менее реакционноспособны и имеют полимерное
строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
При длительном хранении, а также при нагревании белый
фосфор переходит в красную модификацию (впервые его получили лишь 1847 году).
Название красный фосфор относится сразу к нескольким модификациям, различающихся по плотности и окраске:
она колеблется от оранжевой до темно-красной и даже фиолетовой. Все
разновидности красного фосфора нерастворимы в органических растворителях, и по
сравнению с белым фосфором они менее реакционноспособны и имеют полимерное
строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи (рис.2).
Красный фосфор находит
применение в металлургии, производстве полупроводниковых материалов и ламп
накаливания, используется в спичечном производстве.
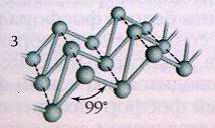 Наиболее стабильной модификацией фосфора является черный
фосфор. Его получают аллотропным превращением белого фосфора при t=2200C и повышенным давлением. По внешнему
виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При
нагревании без доступа воздуха он, как и красный, переходит в пар, из которого
конденсируется в белый фосфор.
Наиболее стабильной модификацией фосфора является черный
фосфор. Его получают аллотропным превращением белого фосфора при t=2200C и повышенным давлением. По внешнему
виду он напоминает графит. Кристаллическая структура черного фосфора слоистая, состоящая из гофрированных слоев (рис.3). Черный фосфор – это наименее активная модификация фосфора. При
нагревании без доступа воздуха он, как и красный, переходит в пар, из которого
конденсируется в белый фосфор.
Оксид фосфора (V)
|
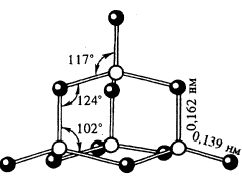
Фосфор образует
несколько оксидов. Важнейшим из них является оксид фосфора (V) P4O10
(Рис.4). Часто его формулу пишут в упрощенном виде – P2O5. В структуре этого оксида сохраняется тетраэдрическое
расположение атомов фосфора.
|
|
P2+5O5 Фосфорный ангидрид (оксид
фосфора (V))
Белые
кристаллы, t0пл.=
5700С, t0кип.=
6000C, r = 2,7 г/см3. Имеет несколько
модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется
как осушитель газов и жидкостей).
Получение
4P + 5O2 ® 2P2O5
Рекомендуем скачать другие рефераты по теме: документ реферат, конспект лекций.
Предыдущая страница реферата |
1
2
3
4
5
6
7
8 |
Следующая страница реферата